Содержание
- 2. Сафиканов А.Ф. 1. История открытия галогенов 2. Положение в Периодической системе 3. Химические свойства 4. Применение
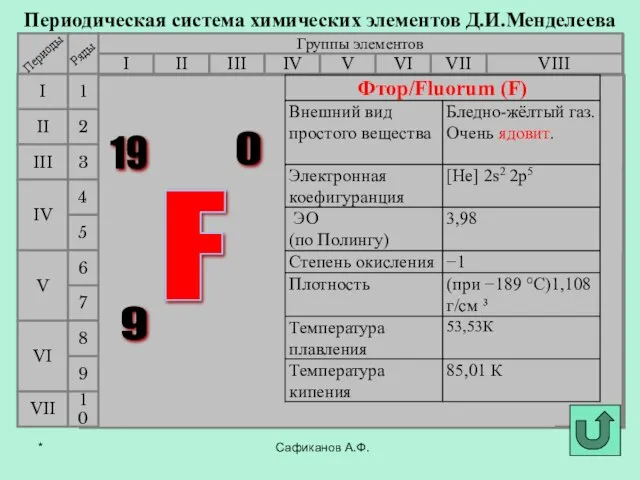
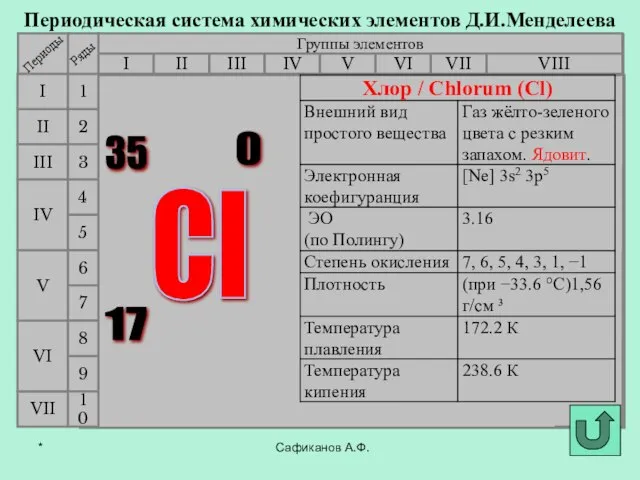
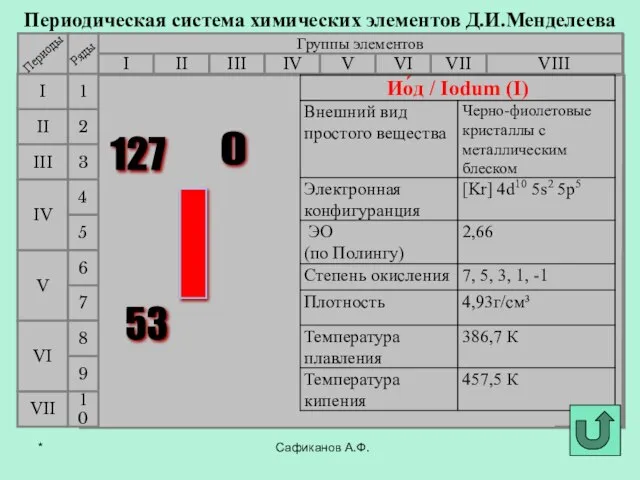
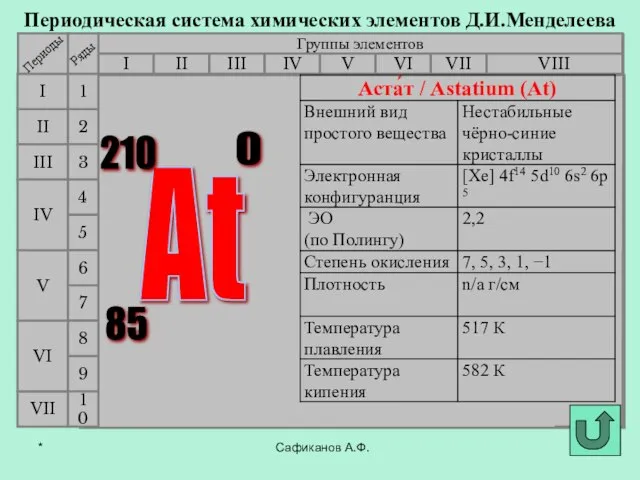
- 3. Фтор История открытия галогенов Сафиканов А.Ф. Хлор Бром Йод Астат *
- 4. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в
- 5. В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал
- 6. В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал
- 7. В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого
- 8. В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат
- 9. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 10. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 11. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 12. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 13. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 14. Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI
- 15. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с
- 16. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с
- 17. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами:
- 18. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами:
- 19. Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами Al + Br2 →
- 20. Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами 2Al + 3Br2 →
- 21. Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg +
- 22. Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg +
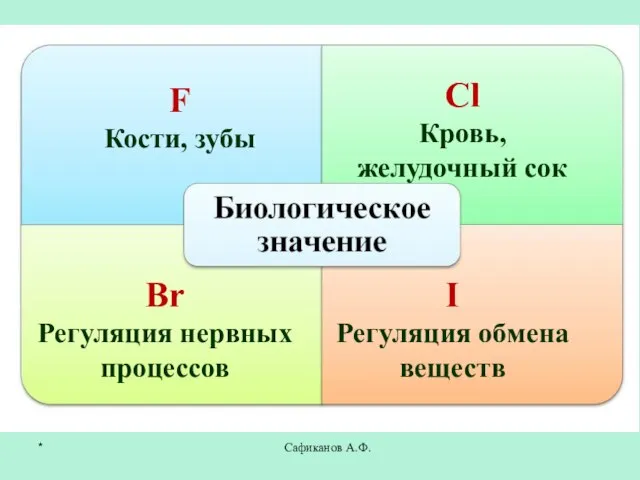
- 23. Сафиканов А.Ф. F Кости, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена
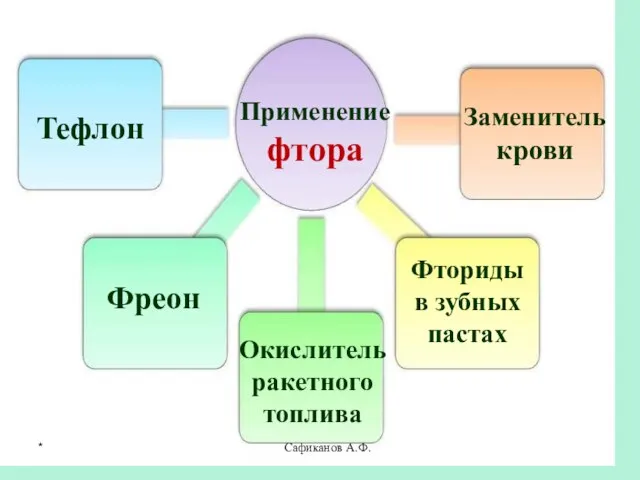
- 24. Сафиканов А.Ф. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах *
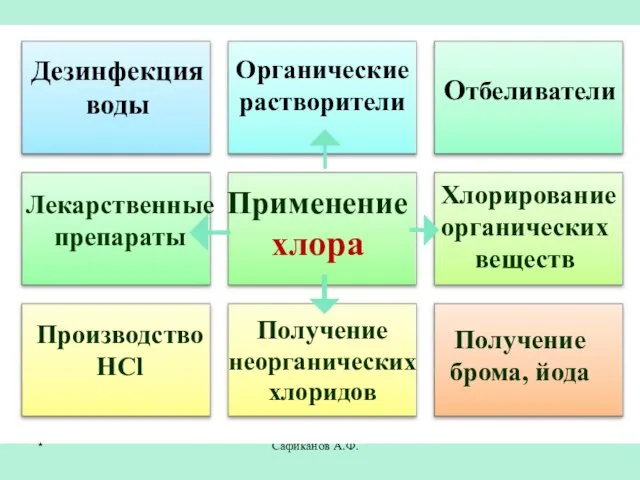
- 25. Сафиканов А.Ф. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты
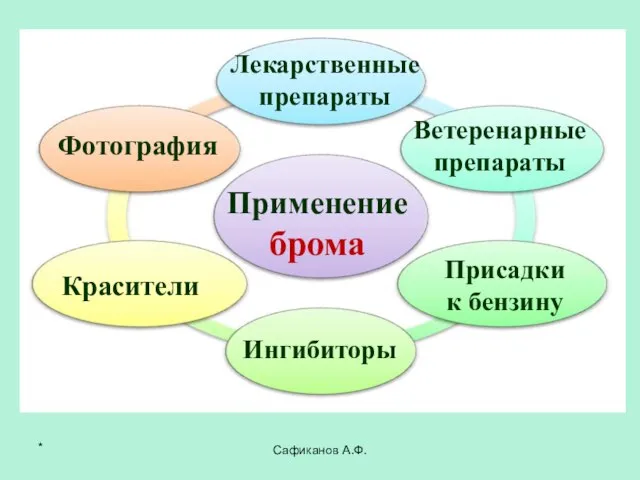
- 26. Сафиканов А.Ф. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину *
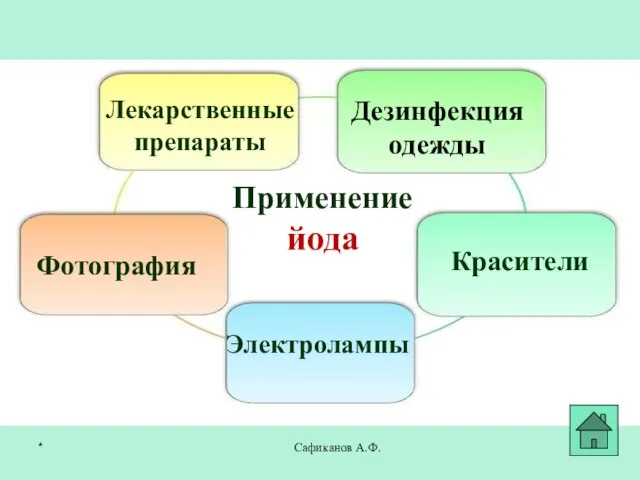
- 27. Сафиканов А.Ф. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы *
- 28. Физические свойства галогенов Заполни пропуски Фтор - , в воде , так как интенсивно с ней
- 29. Химические свойства галогенов Поставь коэффициенты Сафиканов А.Ф. Na + Cl2 = NaCl S + F2 =
- 30. Химические свойства галогенов Найди соответствие между исходными веществами и продуктами реакций Сафиканов А.Ф. Xe + 2F2
- 31. Сафиканов А.Ф. § 17, упр.5, 8 стр 63. Дополнительно: ссылка на сайт учителя химии Сафиканова А.Ф.
- 32. Сафиканов А.Ф. Спасибо за урок! Благодарю за сотрудничество. *
- 34. Скачать презентацию






















 Продолжение классификации
Продолжение классификации Ковалентная химическая связь
Ковалентная химическая связь Щелочные металлы
Щелочные металлы Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Основные понятия химии
Основные понятия химии Презентация на тему Окислительно-восстановительные реакции: общие сведения
Презентация на тему Окислительно-восстановительные реакции: общие сведения  Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества
Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Витамины. (10 класс)
Витамины. (10 класс) Карбоновые кислоты
Карбоновые кислоты Метаболизм чужеродных соединений
Метаболизм чужеродных соединений Алкины
Алкины Полиамиды (ПА)
Полиамиды (ПА) Презентация на тему Обобщение знание и умений и предельных и непредельных углеводородах
Презентация на тему Обобщение знание и умений и предельных и непредельных углеводородах  Углерод
Углерод Природные источники углеводородов
Природные источники углеводородов Алкилирование. Алкилирующие агенты
Алкилирование. Алкилирующие агенты Основания как электролиты
Основания как электролиты Органическая химия
Органическая химия Типы химических реакций
Типы химических реакций Презентация на тему Полимеры и их получение
Презентация на тему Полимеры и их получение  Кислородсодержащие органические вещества. Тест
Кислородсодержащие органические вещества. Тест Общие знания по курсу неорганической химии
Общие знания по курсу неорганической химии Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Генетич_связь_Проявление_периодического_закона
Генетич_связь_Проявление_периодического_закона Аминокислоты. Пептиды
Аминокислоты. Пептиды Неорганические окислители и восстановители
Неорганические окислители и восстановители Презентация на тему Законы электролиза
Презентация на тему Законы электролиза