Содержание
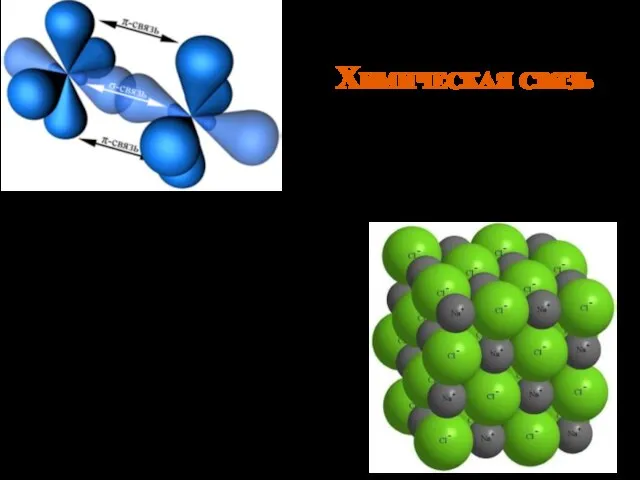
- 2. Химическая связь Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы,
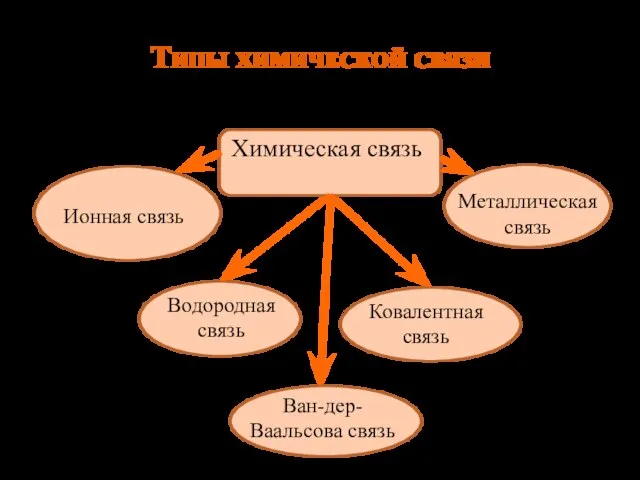
- 3. Типы химической связи Химическая связь Ионная связь Металлическая связь Водородная связь Ковалентная связь Ван-дер-Ваальсова связь
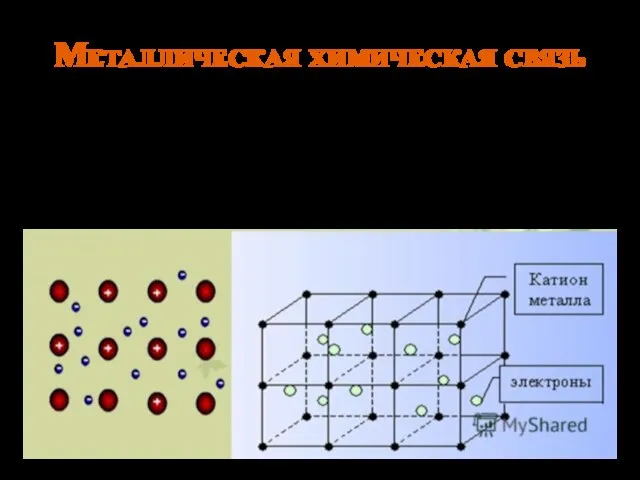
- 4. Металлическая химическая связь Связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической
- 5. Особенности металлической связи Металлическую связь образуют элементы, атомы которых на внешнем уровне имеют мало валентных электронов
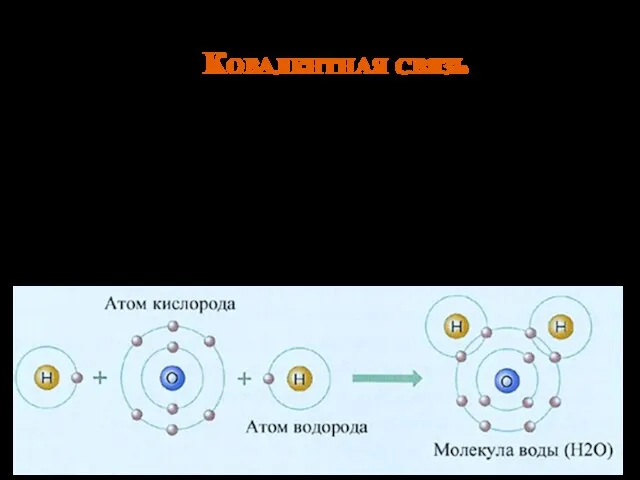
- 6. Ковалентная связь Ковалентная связь – это связь, возникающая между атомами за счет образования общих электронных пар.
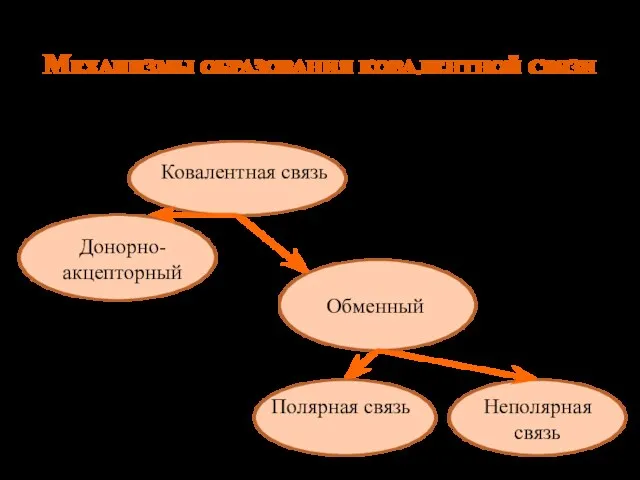
- 7. Механизмы образования ковалентной связи Ковалентная связь Донорно-акцепторный Обменный Полярная связь Неполярная связь Обменный механизм за счет
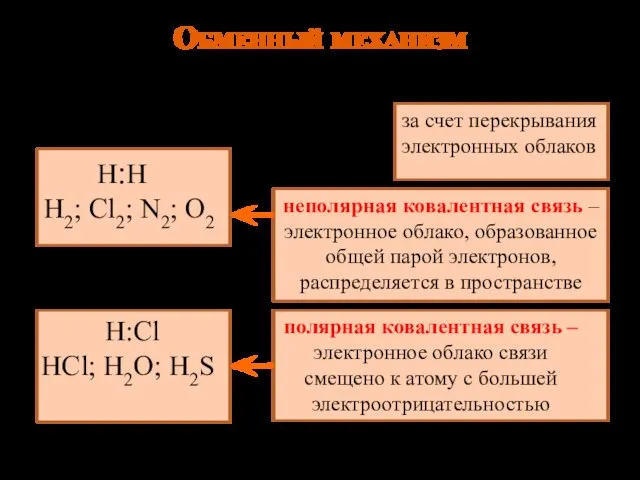
- 8. Обменный механизм за счет перекрывания электронных облаков Н:Н Н2; Cl2; N2; O2 неполярная ковалентная связь –
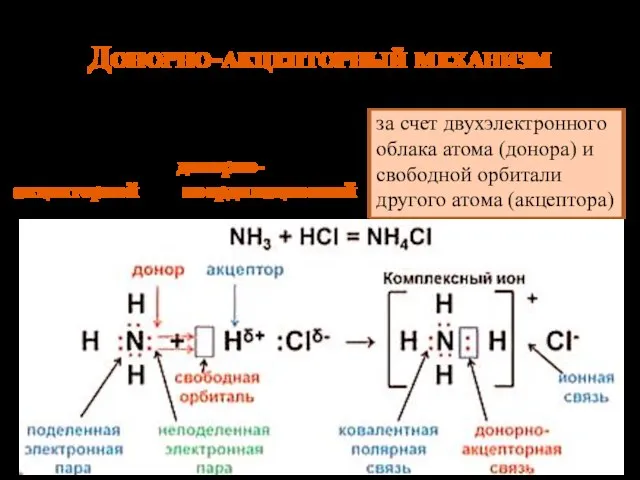
- 9. Донорно-акцепторный механизм за счет двухэлектронного облака атома (донора) и свободной орбитали другого атома (акцептора) Связь называется
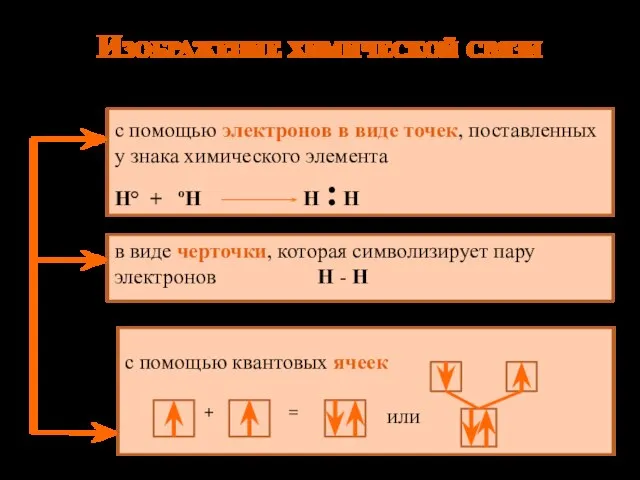
- 10. Изображение химической связи с помощью электронов в виде точек, поставленных у знака химического элемента Н° +
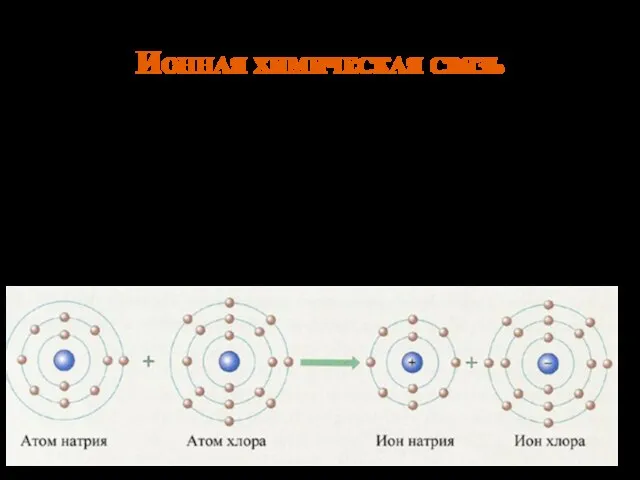
- 11. Ионная химическая связь Ионная связь – химическая связь между ионами, осуществляемая электростатическим притяжением. Образуется между атомами,
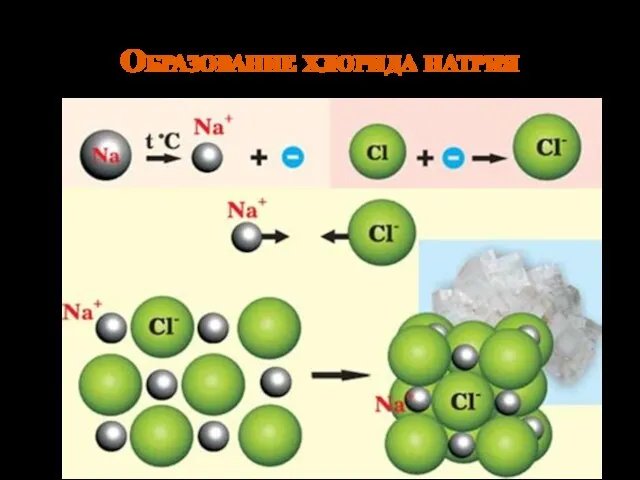
- 12. Образование хлорида натрия
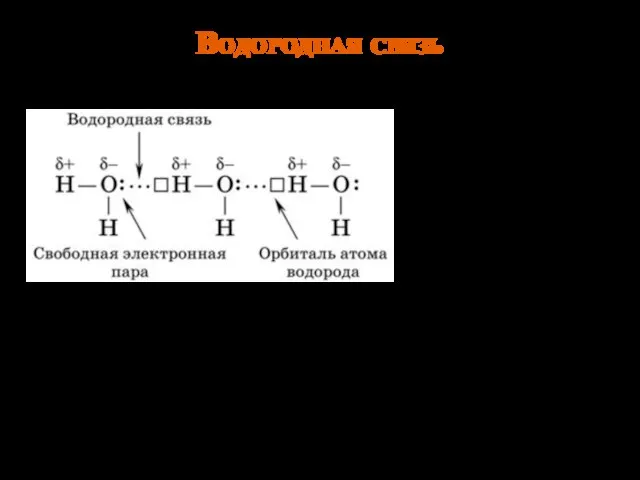
- 13. Водородная связь Связь между атомом водорода , соединенным с атомом сильно электроотрицательного элемента, одной молекулы и
- 14. Особенности водородной связи Связь относится к межмолекулярной; возможно образование внутримолекулярной водородной связи. Водородная связь слабая. Тем
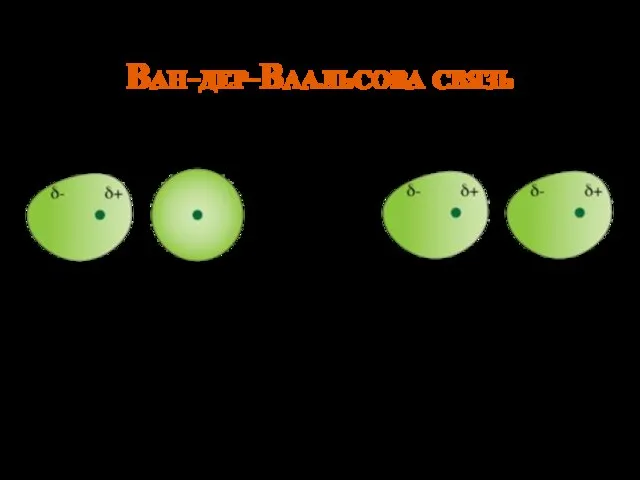
- 15. Ван-дер-Ваальсова связь
- 18. Скачать презентацию


 Spectroscopy. U.V. Lect.2
Spectroscopy. U.V. Lect.2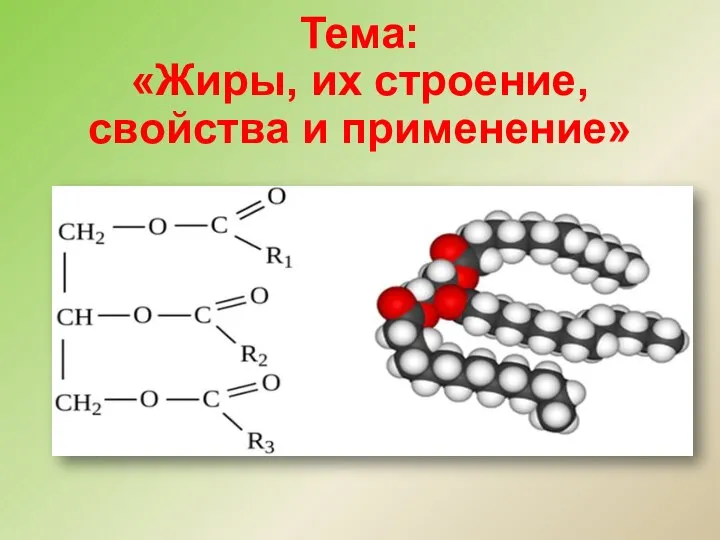 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Использование элементов модульной технологии на уроках химии
Использование элементов модульной технологии на уроках химии Простые вещества – металлы и неметаллы
Простые вещества – металлы и неметаллы Классификация химических реакций. Окислительно-восстановительные реакции
Классификация химических реакций. Окислительно-восстановительные реакции Нуклеиновые кислоты (НК)
Нуклеиновые кислоты (НК) Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В.
Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В. Подготовка к ГИА по химии
Подготовка к ГИА по химии Моль с точки зрения технолога
Моль с точки зрения технолога Общая характеристика металлов
Общая характеристика металлов Химия һәм сәламәт яшәү рәвеше
Химия һәм сәламәт яшәү рәвеше Классификация органических веществ Химия. 10 класс Абрамова С.И.
Классификация органических веществ Химия. 10 класс Абрамова С.И. Химическая связь
Химическая связь Спирты и фенолы
Спирты и фенолы Основания. Структурная формула
Основания. Структурная формула Знакомство с химической посудой и лабораторным оборудованием. Правила техники безопасности
Знакомство с химической посудой и лабораторным оборудованием. Правила техники безопасности Responsible Aluminium Framework
Responsible Aluminium Framework Физические свойства воды.Перегонка. Растворимость веществ в воде
Физические свойства воды.Перегонка. Растворимость веществ в воде Термохимическое уравнение реакции полного сгорания ацетилена
Термохимическое уравнение реакции полного сгорания ацетилена Инертные газы и перспективы их применения
Инертные газы и перспективы их применения Презентация на тему Жизнь и деятельность Д.И. Менделеева
Презентация на тему Жизнь и деятельность Д.И. Менделеева  Электролиз
Электролиз Оксиды неметаллов и металлов. Состав и названия
Оксиды неметаллов и металлов. Состав и названия Алканы
Алканы Ионные уравнения
Ионные уравнения Производство чугуна и стали
Производство чугуна и стали Углерод. Электронная формула
Углерод. Электронная формула Растворы. Лекция №4
Растворы. Лекция №4