Содержание
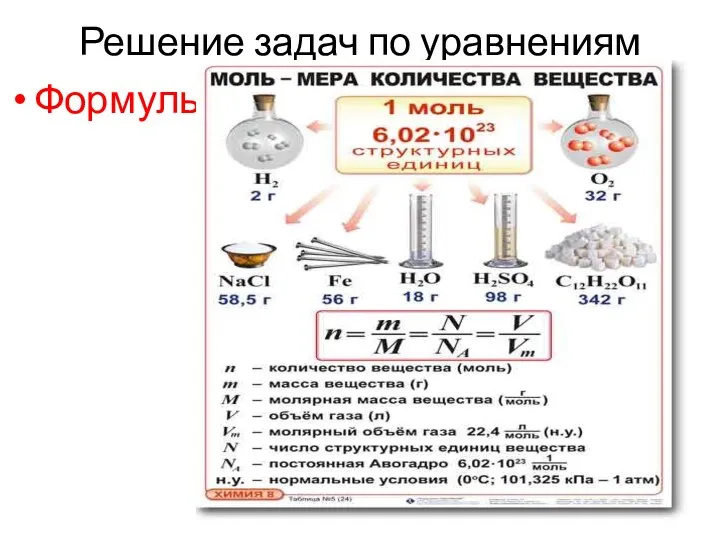
- 2. Решение задач по уравнениям Формулы
- 3. Урок 2 Решение задач
- 4. Урок 2 Решение задач Какая масса натрия вступит в реакцию с 2 моль хлора? x г.
- 5. Решение задач Сколько моль кислорода потребуется для сжигания 10 литров водорода? 2. Сколько литров водорода необходимо
- 6. Решение задач 1) 10 л. Х моль 2H₂ + O₂ = 2 H₂O 2 моль 1
- 7. Решение задач 3 ) 3 моль Х г. Cl₂ + 2 Na = 2 NaCl 1
- 8. Решение задач – одно из реагирующих вещества дано в избытке «Избыток и недостаток» Записать уравнение реакции
- 9. Решение задач
- 10. Решение задач Определите количество вещества (моль) железа, которое образуется при взаимодействии 65 г. оксида железа(3) с
- 11. Решение задач 1) 65 г. 15 л. Х г. Fe₂O₃ + 3 H₂ = 2 Fe
- 12. Решение задач 2) 100 г. 35 л. Х моль 2 NaCl + F₂ = Cl₂ +
- 13. Решение задач % от теоретически возможного выхода про- дукта реакции: 1) Записать уравнение реакции и оформить
- 14. Урок 2 Решение задач
- 15. Решение задач 1) При взаимодействии 250г. оксида бария с серной кислотой получили 85 г. сульфата бария.
- 16. Решение задач При взаимодействии 250 г. оксида бария с серной кислотой получили 85 г. сульфата бария.
- 17. Решение задач Определите массу меди, при взаимодействии которой с кислородом получили 48 г. оксида меди (2),
- 18. Решение задач Исходное вещество дано с примесями Записать уравнение реакции и оформить условие задачи Найти массу(объем)
- 19. 1)Какова масса чистого вещества ( карбоната кальция) в известняке? 250г. = 100% Х г. 90% Х
- 20. Решение задач 2) 20 л.95% Х г. 2 Na + Cl₂ = 2 NaCl 1 моль
- 22. Скачать презентацию


















 Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Лакокрасочные материалы
Лакокрасочные материалы Серная кислота
Серная кислота Химия углеводов
Химия углеводов Стекло. Определение стекла
Стекло. Определение стекла Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Энергетика хим процессов
Энергетика хим процессов Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Сахар-рафинад
Сахар-рафинад Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола
Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола Мышьяк (As)
Мышьяк (As) Растворы и их концентрация. Массовая доля растворенного вещества
Растворы и их концентрация. Массовая доля растворенного вещества Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот teoriya_elektroliticheskoy_dissotsiatsii
teoriya_elektroliticheskoy_dissotsiatsii Карбоновые кислоты
Карбоновые кислоты Презентация на тему Химические уравнения. Реакции обмена
Презентация на тему Химические уравнения. Реакции обмена  Характеристика углерода
Характеристика углерода Химические вещества, используемые при пайке
Химические вещества, используемые при пайке Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Свойства металлов. Лекция №8
Свойства металлов. Лекция №8 Метанол. Способы получения
Метанол. Способы получения Углеводороды: номенклатура
Углеводороды: номенклатура Реактор гидроочистки дизельного топлива. Контроль и автоматизация
Реактор гидроочистки дизельного топлива. Контроль и автоматизация Водопроводная вода и её фильтрация
Водопроводная вода и её фильтрация Незаменимая уксусная кислота
Незаменимая уксусная кислота