Содержание
- 2. Светоносный элемент Урок №8
- 3. А.Г.Волкова 1. Фосфор – химический элемент Характеристика по положению Строение атома Электронная конфигурация, энергетическая диаграмма Валентность,
- 4. А.Г.Волкова Фосфор – химический элемент Задание: Используя периодическую систему химических элементов, дайте характеристику х.э. фосфору Электронная
- 5. А.Г.Волкова Фосфор – химический элемент Задание: Зарисуйте схему строения атома азота и фосфора. Отметьте сходство и
- 6. А.Г.Волкова 2. Нахождение в природе Л.- 0,105% по массе Г. - 0,07 мг/л Ч. – 1%
- 7. А.Г.Волкова 3. Биологическая роль фосфора Задание: «Почему академик А.Е. Ферсман назвал фосфор «элементом жизни и мысли»?
- 8. А.Г.Волкова 4. Фосфор - простое вещество Аллотропия Физические свойства Химические свойства Применение История открытия фосфора
- 9. А.Г.Волкова Модификации фосфора белый красный черный металлический Вывод: разное строение кристаллической решетки Вопрос: В чем причина
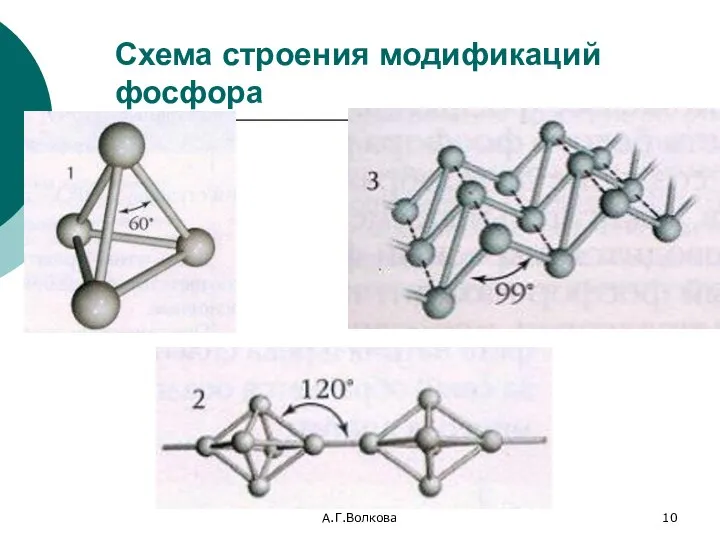
- 10. А.Г.Волкова Схема строения модификаций фосфора
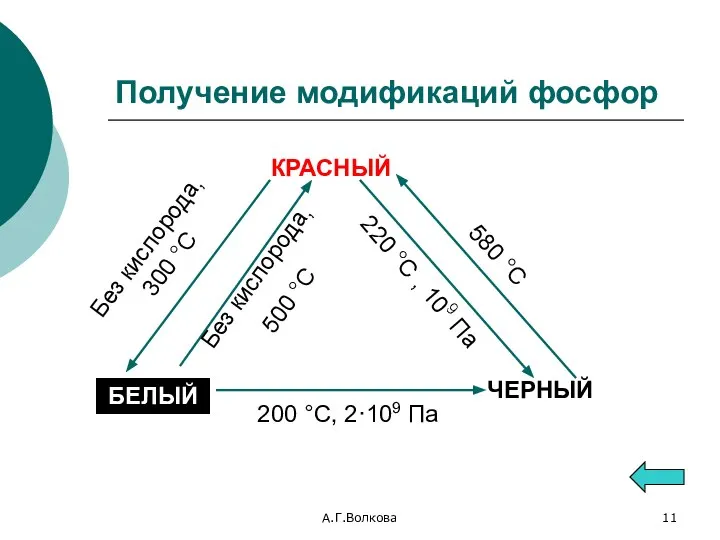
- 11. А.Г.Волкова Получение модификаций фосфор КРАСНЫЙ БЕЛЫЙ ЧЕРНЫЙ Без кислорода, 500 °С 220 °С , 109 Па
- 12. А.Г.Волкова Физические свойства Задание: проанализируйте Таблицу №18 стр.104 и ответьте на вопрос «Химическая активность какого фосфора
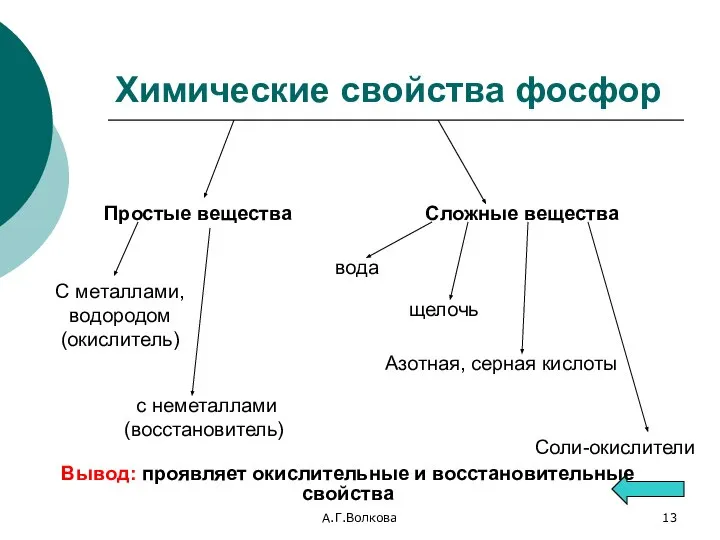
- 13. А.Г.Волкова Химические свойства фосфор Простые вещества с неметаллами (восстановитель) С металлами, водородом (окислитель) Сложные вещества вода
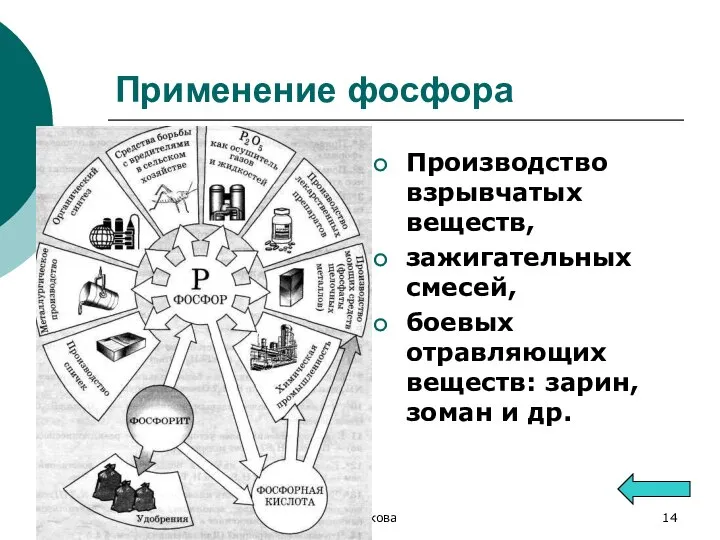
- 14. А.Г.Волкова Применение фосфора Производство взрывчатых веществ, зажигательных смесей, боевых отравляющих веществ: зарин, зоман и др.
- 15. А.Г.Волкова История открытия фосфора Вопрос: Кем и когда был открыт фосфор? Фосфор открыт немецким химиком Хеннигом
- 16. А.Г.Волкова Домашнее задание П. 29 читать Стр.105 ? 1 и 3 Какова масса фосфора в вашем
- 17. А.Г.Волкова Закрепление Почему атом фосфора больше атома азота, от чего это зависит? Какие валентности проявляет фосфор?
- 19. Скачать презентацию












 Периодический закон и периодическая система химических элементов. 11 класс
Периодический закон и периодическая система химических элементов. 11 класс Полимеры
Полимеры Кремний и его соединения
Кремний и его соединения Нуклеиновые кислоты
Нуклеиновые кислоты Химические реакции
Химические реакции Моделирование фазовых систем. Тройные взаимные системы
Моделирование фазовых систем. Тройные взаимные системы Кислоты 8 класс - Презентация_
Кислоты 8 класс - Презентация_ Вода. Физические и химические свойства
Вода. Физические и химические свойства Fosforan V wapnia Ca3(PO4)2
Fosforan V wapnia Ca3(PO4)2 Оксиды углерода
Оксиды углерода Классификация органических веществ Химия. 10 класс Абрамова С.И.
Классификация органических веществ Химия. 10 класс Абрамова С.И. Металлы. Повторение
Металлы. Повторение Алкины. Номенклатура алкинов
Алкины. Номенклатура алкинов Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Свинец (plumbum)
Свинец (plumbum) Формула аспирина. Решение задач
Формула аспирина. Решение задач История развития органической химии
История развития органической химии Закалка без полиморфного превращения
Закалка без полиморфного превращения Презентация на тему Каучуки
Презентация на тему Каучуки  Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения
Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения Положение металлов в Периодической системе химических элементов Д.И.Менделеева
Положение металлов в Периодической системе химических элементов Д.И.Менделеева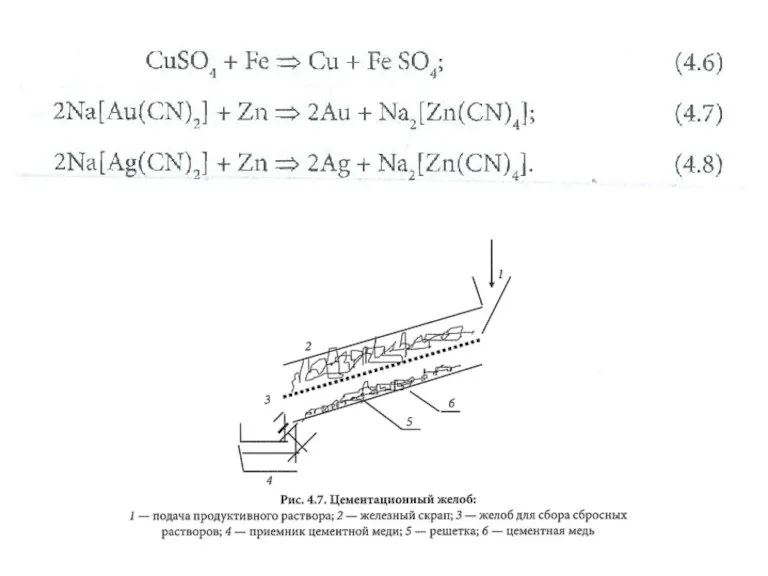 Гальванохимическая очистка. Сорбция
Гальванохимическая очистка. Сорбция Кислород. Применение и круговорот в природе. 8 класс
Кислород. Применение и круговорот в природе. 8 класс Сравнительная характеристика бензольного кольца и олимпийских колец
Сравнительная характеристика бензольного кольца и олимпийских колец Кальций, железо. Горение стальной ваты и железного порошка
Кальций, железо. Горение стальной ваты и железного порошка Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Водородные соединения неметаллов
Водородные соединения неметаллов Химические уравнения
Химические уравнения