Содержание
- 2. В 1669 Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте
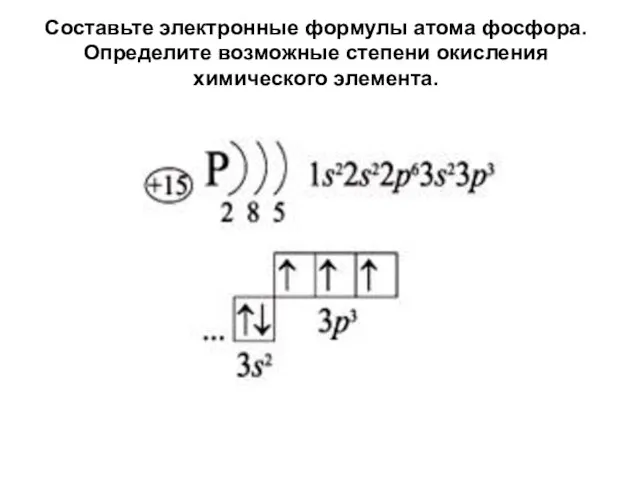
- 3. Составьте электронные формулы атома фосфора. Определите возможные степени окисления химического элемента.
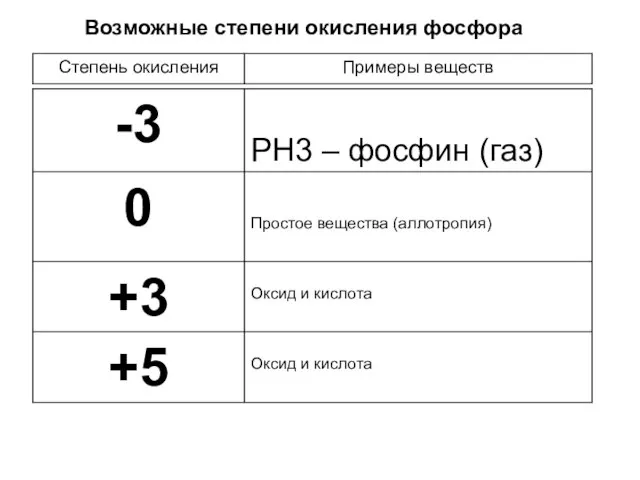
- 4. Возможные степени окисления фосфора
- 6. Физические свойства фосфора АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА: Белый фосфор Р4 -молекулярная решетка ЯД !!! 2.Красный фосфор Рп
- 7. Аллотропные модификации фосфора БЕЛЫЙ ФОСФОР КРАСНЫЙ ФОСФОР ЧЕРНЫЙ ФОСФОР
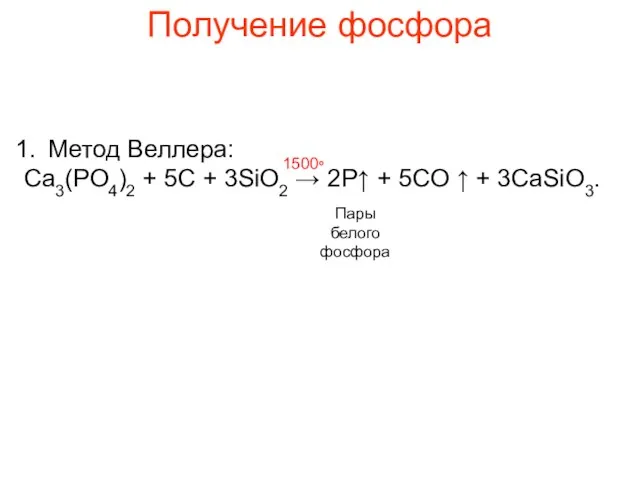
- 8. Получение фосфора Метод Веллера: Ca3(PO4)2 + 5C + 3SiO2 → 2P↑ + 5CO ↑ + 3CaSiO3.
- 9. Химические свойства фосфора 1) Фосфор легко окисляется кислородом: 4P + 5O2 → 2P2O5, 4P + 3O2
- 10. Химические свойства фосфора Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и
- 11. Химические свойства фосфора 4) Взаимодействует с водой, при этом диспропорционирует ( 700-800°C, кат.Pt? Cu): 4Р +
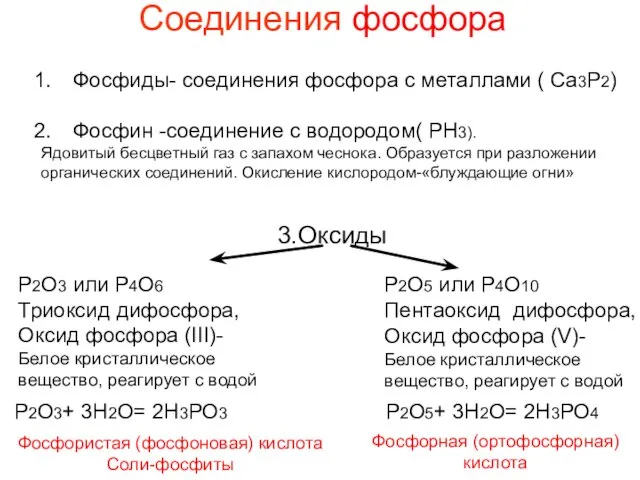
- 12. Соединения фосфора Фосфиды- соединения фосфора с металлами ( Ca3P2) Фосфин -соединение с водородом( РН3). Ядовитый бесцветный
- 13. Р2О5- кислотный оксид Взаимодействует: 1) с водой, образуя при этом различные кислоты Р2О5 + Н2О =
- 14. Р2О5- водоотнимающий реагент Фосфорный ангидрид отнимает у других веществ не только гигроскопическую влагу, но и химически
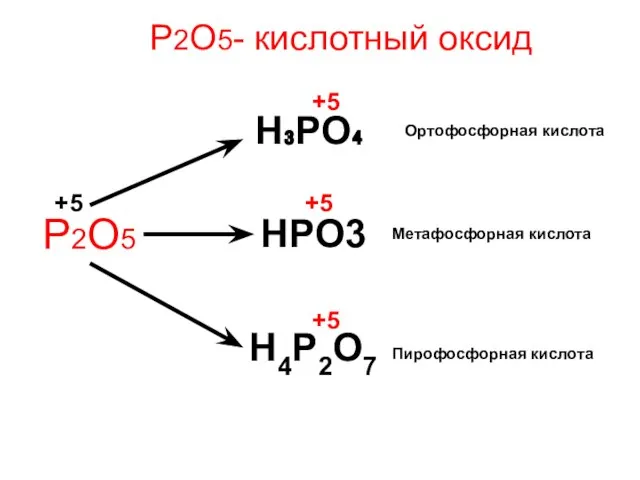
- 15. Р2О5- кислотный оксид Р2О5 H₃PO₄ HPO3 H4P2O7 Пирофосфорная кислота Метафосфорная кислота Ортофосфорная кислота +5 +5 +5
- 16. Физические свойства ортофосфорной кислоты При обычной температуре безводная Н3РO4 представляет собой прозрачное кристаллическое вещество, очень гигроскопичное
- 17. Исходным сырьем для промышленного получения Н3РO4 служит природный фосфат Са3(РO4)2: I. Са3(РO4)2 → Р → Р2O5
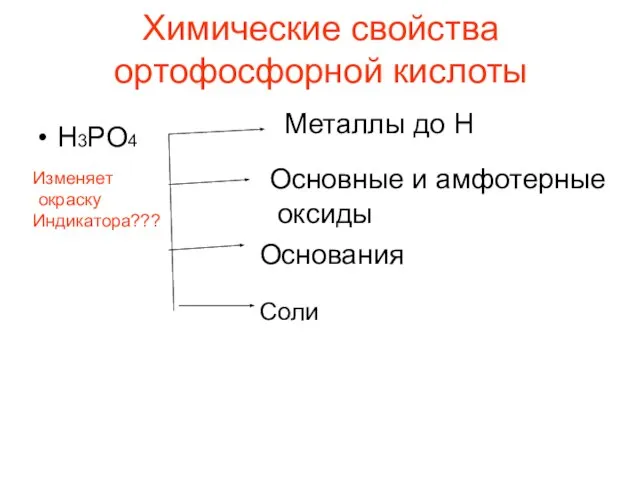
- 18. Химические свойства ортофосфорной кислоты Н3РО4 Металлы до Н Основные и амфотерные оксиды Основания Соли Изменяет окраску
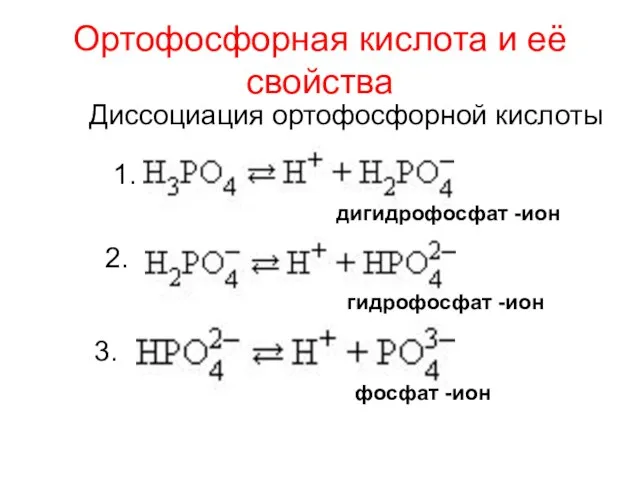
- 19. Ортофосфорная кислота и её свойства 1. 2. 3. дигидрофосфат -ион гидрофосфат -ион фосфат -ион Диссоциация ортофосфорной
- 20. Ортофосфорная кислота и её свойства Н3РО4+Са= Н3РО4+СаО= Н3РО4+Са(ОН)2= Н3РО4+СаСО3= Допишите уравнения реакций
- 21. Качественная реакция на фосфат - ионы K3PO4+3AgNO3=Ag3PO4↓+3KNO3 при этом выпадает жёлтый осадок нитрата серебра
- 22. Соли ортофосфорной кислоты Н3РO4 как 3-основная кислота образует 3 типа солей, которые имеют большое практическое значение.
- 24. Скачать презентацию













 Типичные реакции кислот
Типичные реакции кислот Презентация на тему Химические антонимы
Презентация на тему Химические антонимы  Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов
Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов Углеводы, 2 часть. Лекция 15
Углеводы, 2 часть. Лекция 15 Алканы и алкены
Алканы и алкены Эксперимент Осадки и растворы, 8 класс
Эксперимент Осадки и растворы, 8 класс Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Классификация пластмасс. Свойства и применение пластмасс
Классификация пластмасс. Свойства и применение пластмасс Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Презентация на тему Классификация химических реакций
Презентация на тему Классификация химических реакций  Кислоты
Кислоты Деятельностный подход в изучении химии
Деятельностный подход в изучении химии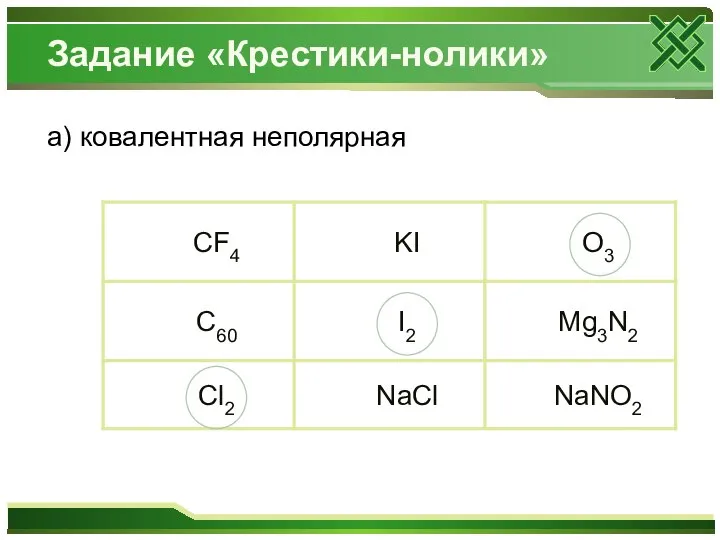 Степень окисления. 8 класс
Степень окисления. 8 класс Степень окисления
Степень окисления Типы химических связей
Типы химических связей ОВР
ОВР 11_PERMANGANATOMETRIYa_JODOMETRIYa_1
11_PERMANGANATOMETRIYa_JODOMETRIYa_1 Применения химического анализа людьми в разных родах занятий
Применения химического анализа людьми в разных родах занятий Кинетика физико-химических процессов
Кинетика физико-химических процессов Серная кислота и ее соли
Серная кислота и ее соли Еще раз про электролиз…
Еще раз про электролиз… Ионы. Ионная связь.
Ионы. Ионная связь. Строение и свойства металлов
Строение и свойства металлов 4505ab8713f54e72bb388461c5e134ac (1)
4505ab8713f54e72bb388461c5e134ac (1) Химия һәм сәламәт яшәү рәвеше
Химия һәм сәламәт яшәү рәвеше Застосування рідких кристалів
Застосування рідких кристалів Алкены (непредельные углеводороды)
Алкены (непредельные углеводороды) Elektroliz_Gidroliz
Elektroliz_Gidroliz