Содержание
- 2. Галогеноводородные кислоты
- 4. Получение хлороводорода В промышленности: H2 + Cl2 = 2HCl В лаборатории: NaCl + H2SO4 = NaHSO4
- 5. Соляная кислота — это бесцветная жидкость, которая дымится на воздухе. Соляная кислота тяжелее воды.
- 6. Химические свойства соляной кислоты Взаимодействие с металлами: 6HCl + 2Al = 2AlCl3 + 3H2↑ Взаимодействие с
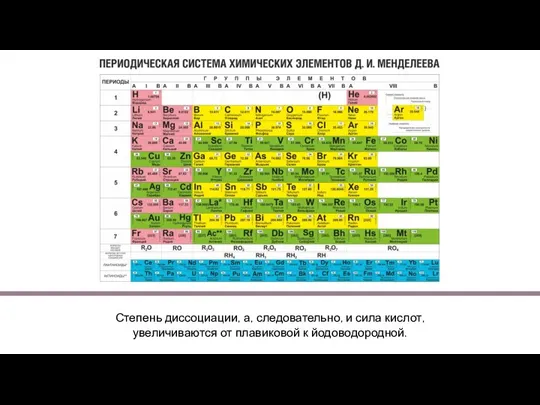
- 8. Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды и йодиды. Большинство таких солей хорошо растворимы в воде.
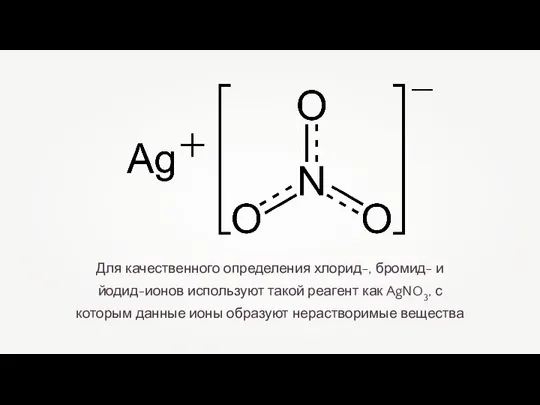
- 9. Для качественного определения хлорид-, бромид- и йодид-ионов используют такой реагент как AgNO3, с которым данные ионы
- 10. При взаимодействии хлоридов (и самой соляной кислоты) с нитратом серебра образуется белый творожистый осадок хлорида серебра.
- 11. Для определения ионов фтора чаще всего используют растворимые соли кальция, в результате реакции образуется нерастворимое вещество
- 12. Ввиду большой реакционной способности галогенов в природе они встречаются исключительно в виде соединений.
- 17. Скачать презентацию











 Презентация на тему Минеральные вещества
Презентация на тему Минеральные вещества  Коррозия металла
Коррозия металла Соль не только блюдо
Соль не только блюдо Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14
Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14 Биотит и тальк
Биотит и тальк Zirconium Dioxide
Zirconium Dioxide Ископаемые углеводороды
Ископаемые углеводороды Осторожно, химия
Осторожно, химия Презентация на тему Подгруппа азота
Презентация на тему Подгруппа азота  Комплексные соединения
Комплексные соединения Пакет заданий №2. Команда вечерний дозор
Пакет заданий №2. Команда вечерний дозор Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия
Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия Природный газ
Природный газ Кислород Общая характеристика, получение и свойства
Кислород Общая характеристика, получение и свойства Презентация на тему Нефть и способы ее переработки
Презентация на тему Нефть и способы ее переработки  Применение этилена на основе свойств
Применение этилена на основе свойств Минералы
Минералы Сравнительная характеристика стиральных порошков
Сравнительная характеристика стиральных порошков Генетическая связь веществ. Виды реакций
Генетическая связь веществ. Виды реакций Оценка качества пищевой соли, реализуемой в розничной торговле
Оценка качества пищевой соли, реализуемой в розничной торговле Презентация на тему Интерактивная игра "Химический лабиринт"
Презентация на тему Интерактивная игра "Химический лабиринт"  Путешествие в мир удивительных веществ Оксиды. Химия 8 класс
Путешествие в мир удивительных веществ Оксиды. Химия 8 класс Презентация на тему Окислительно-восстановительные реакции
Презентация на тему Окислительно-восстановительные реакции  Состав атома
Состав атома История чернил
История чернил Элемент Фосфор
Элемент Фосфор Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики
Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики В1 витамині
В1 витамині