Слайд 2Аналитическая химия – это наука о способах идентификации химических соединений, о принципах

и методах определения химического состава веществ и их структуры.
Она является научной основой химического анализа.
Слайд 3Химический анализ – это получение опытным путем данных о составе и свойствах

объектов.
Аналитические химические реакции - при которых возникает аналитический эффект.
Слайд 4Химический анализ в зависимости от решаемых аналитических задач разделяют на качественный, количественный,

структурный и системный.
В зависимости от вида идентифицируемых частиц различают элементный, молекулярный, изотопный и фазовый .
Слайд 5Аналитический сигнал - любое свойство вещества, которое можно использовать для установления качественного

или количественного состава объекта.
Все методы аналитической химии основаны на получении и измерении аналитического сигнала (АС).
Слайд 6
Получение аналитического сигнала
химические реакции (кислотно-основные, окислительно-восстановительные, комплексообразования);
различные процессы (осаждение, растворение, экстракция);
различные

свойства (химические, физические, биологические).
Слайд 7Классификация по принципу получения аналитического сигнала
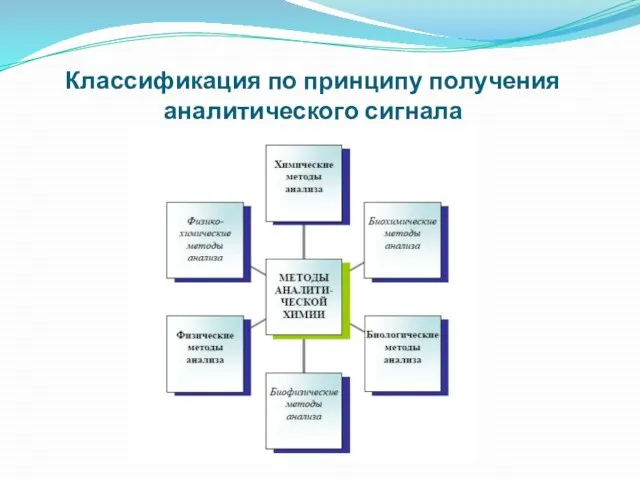
Слайд 81. Химические методы анализа - использование химических реакций. Наблюдают аналитический эффект или

измеряют аналитический сигнал.
2. Физические методы анализа - измерение физических свойств веществ, зависящих от химического состава.
Химические реакции либо совсем не проводят, либо они играют вспомогательную роль. Основной упор делают на измерение АС.
3. Биологические методы анализа - измерение интенсивности развития микроорганизмов в зависимости от количества анализируемого вещества – аминокислоты, фермента, витамина и т. п.
Об интенсивности роста судят по числу выросших колоний или их диаметру.
Слайд 9Группы комбинированных (переходных) методов анализа
1. Физико-химические методы анализа основаны на измерении

физических свойств веществ, которые появляются или изменяются в результате химических реакций.
2. Биофизические методы анализа- интенсивность роста колоний микроорганизмов зависит от интенсивности помутнения среды (нефелометрия).
3. Биохимические методы анализа - интенсивность роста колоний микроорганизмов определяют по количеству образовавшейся молочной кислоты (титриметрический), высушенной массе выросших микроорганизмов (гравиметрический).
Слайд 10К группе химических методов относят классические (давно известные и хорошо изученные) методы

– гравиметрию, титриметрию, газоволюмометрический анализ, кинетические и др. методы.
В качестве аналитического сигнала измеряют массу или объем.
Слайд 11СН3СООН + NаОН → СН3COONа + Н2О
определяемое р-р титранта В
в-во А (рабочий

)
Титриметрический анализ основан на точном измерении объема стандартного раствора реагента (титранта), израсходованного на реакцию с определяемым веществом.
Титранты (растворы с точно известной концентрацией) делятся на первичные и вторичные стандарты.
Слайд 12Первичный стандарт – стандартный раствор, приготовленный по точной навеске.
Требования:
Вещество д.б. химически

чистым (ч.д.а.)
состав, точно соответствующий химической формуле,
устойчив на воздухе ,
иметь возможно большую молярную массу эквивалента,
доступность,
легко очищаться от примесей.
Слайд 13Вторичные стандарты (стандартизированные растворы) – стандартный раствор, характеристики которого установлены по первичному

стандарту.
Стандартизация раствора титранта - установление его точной концентрации (относительная погрешность + 0,1%.
Слайд 14Титрование – процесс постепенного прибавления небольших количеств титранта В к определяемому веществу

А до момента, когда вещества прореагируют между собой в эквивалентных количествах (ТЭ), т. е. в строгом соответствии со стехиометрией реакции.
В таком случае справедлив закон эквивалентов, составляющий основу расчетов в титриметрии:
n(A) = n(B)
Слайд 15Точка эквивалентности (ТЭ) – момент, когда определяемое вещество полностью прореагировало с раствором

титранта (понятие теоретическое).
Конечная точка титрования (КТТ)- момент изменения физического свойства (окраски) титруемого раствора, связанный с эквивалентностью. Чаще всего фиксируется индикаторным или инструментальным способом (понятие практическое).
Слайд 16Конечную точку титрования (КТТ)- фиксируют визуально по изменению окраски титруемого раствора или

индикатора, который добавляют в ходе реакции, или устанавливают по излому или скачку на кривой титрования.
Слайд 17 К химической реакции титрования предъявляются следующие требования:
1) строгая стехиометричность,
2) отсутствие побочных реакций;

3) высокая скорость;
4) практическая необратимость;
5) наличие подходящего индикатора или другого способа фиксирования ТЭ.
Слайд 18В титриметрии используют мерную посуду:
мерные колбы – для приготовления растворов;
пипетки –

для отмеривания определенного объема раствора
бюретки – для измерения объема титранта.
Слайд 19 Эквивалент - реальная или условная частица вещества, которая в данной кислотно-основной реакции

эквивалентна одному иону водорода или в данной реакции окисления-восстановления – одному электрону.
Дробь, показывающую, какая часть молекулы или иона является эквивалентом, называют фактором эквивалентности fэкв (А) = 1/z .
Его рассчитывают на основе стехиометрии реакции.
Молярная масса эквивалента вещества А:
M(1/z A) – масса одного моля эквивалента вещества А
M(1/z A) = 1/z M(A)
Слайд 20fэкв (А) – 1/z - фактор эквивалентности вещества А
1) В реакциях

кислотно-основного взаимодействия:
Н3РО4 + NаОН = NаН2РО4 + Н2О
каждый моль ортофосфорной кислоты отдает один моль ионов Н+, т.е. одному иону водорода эквивалентна одна условная единица Н3РО4 т.е. Z =1, fэкв (Н3РО4) = 1
Н3РО4 + 2 NаОН = Nа2Н РО4 + 2 Н2О
один моль кислоты соответствует уже двум ионам Н+, т. е. одному иону водорода эквивалентна ½ условных единиц Н3РО4,
т.е. z = 2, fэкв (Н3РО4) = ½
Н3РО4 + 3 NаОН = Nа3 РО4 + 3 Н2О
1 моль ортофосфорной кислоты соответствует трем ионам Н+, т. е. одному иону водорода эквивалентна 1/3 условных единиц Н3РО4, т.е z = 3, fэкв (Н3РО4) = 1/3.
Слайд 212) В реакциях окисления-восстановления:
5Fе2+ + MnO4- + 8Н+ = 5Fе3+ + Mn2+

+ 4 H2О
Mn7+ + 5е = Mn2+
одному электрону в данной реакции эквивалентна 1/5 доля условной единицы реагирующего вещества КMnO4
т.е. fэкв (КMnO4) = 1/5.
Слайд 22Титр вещества Т по определяемому веществу Х – Т Т/Х , г/мл

- это число граммов компонента Х, эквивалентное в данной реакции числу граммов компонента Т, содержащемуся в 1 мл раствора.
Например, ТNаОН/НСl = 0.0034 г/мл означает:
1мл NаОН эквивалентен 0,0034 г НСl .
Где: Т(Т) –титр титранта, г/см3; г/мл;
М(1/z X) –молярная масса эквивалента определяемого вещества, г/моль;
М(1/z Т) –молярная масса эквивалента титранта, г/моль;
Слайд 23Титр вещества Т(А), г/см3 (г/мл) - массовая концентрация, показывающая, сколько граммов растворенного

вещества А содержится в 1 см3 (мл) раствора:
Слайд 24Молярная концентрация вещества А в растворе С(А), (моль/дм3 ; моль/л) показывает число

молей вещества А, содержащегося в 1 дм3 (л) раствора:
где n(А) –количество вещества A, моль;
m(А) –масса вещества A, г;
М(А) –молярная масса вещества A, г/моль;
Vр-ра –объем раствора вещества A, дм3 (л).
Слайд 25Нормальная концентрация, т.е. молярная концентрация эквивалента вещества А
С[ƒэкв(А)А] или С(1/z А), (моль-экв/л)
![Нормальная концентрация, т.е. молярная концентрация эквивалента вещества А С[ƒэкв(А)А] или С(1/z А),](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/899606/slide-24.jpg)
– число молей эквивалента вещества A, содержащегося в 1 дм3 (л) раствора:
Где:
n(1/z A) –количество вещества эквивалента А, в V дм3 (л) раствора, моль
М(1/z A) – молярная масса эквивалента вещества А, г/моль
1/z –фактор эквивалентности.
Слайд 26Характеристики стандартного раствора :
Нормальная концентрация, т.е. молярная концентрация эквивалента
С[ƒэкв(А)А] или С(1/z
![Характеристики стандартного раствора : Нормальная концентрация, т.е. молярная концентрация эквивалента С[ƒэкв(А)А] или](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/899606/slide-25.jpg)
А),– число молей эквивалентов вещества А, которое содержится в одном литре раствора (моль-экв/л).
2) Титр раствора – масса вещества, содержащегося в одном кубическом сантиметре (или в одном миллилитре) раствора (г /см3 или г/мл).
3) Титр вещества В по определяемому веществу А – Т В/А , г/мл - число граммов компонента А, эквивалентное в данной реакции числу граммов компонента В, содержащемуся в 1 мл раствора.
Например, ТNаОН/НСl = 0.0034 г/мл означает: 1мл NаОН эквивалентен 0,0034 г НСl .
4) Поправочный коэффициент К – число, выражающее отношение действительной (практической) концентрации раствора к заданной (теоретической) концентрации.
Слайд 27Методы титрования в аналитической химии
Прямое титрование
Непосредственное прибавление титранта R к раствору

пробы.
Х + R = Y
В точке эквивалентности n (1/z Х) = n (1/z R),
где n (1/z Х) и n (1/z R) – количества молей эквивалентов Х и R;
1/z – факторы эквивалентности.
Слайд 28 Обратное титрование
проводят по двухстадийной схеме:
Х + R1 = Y1
R1 +

R2 = Y2
Вспомогательный реагент R1 вводят в точно известном количестве, в избытке. Затем непрореагировавшую часть R1 оттитровывают титрантом R2
n (1/z Х) = n (1/z R1) – n (1/z R2)
Слайд 29 Титрование по замещению или заместительное титрование
Х + R1 = Y
Y

+ R2 = Y2
К пробе прибавляют избыток раствора вспомогательного реагента R1, количество образующегося продукта Y будет эквивалентно количеству Х. Затем продукт Y оттитровывают титрантом R2.
Расход титранта пропорционален количеству Х в пробе:
n (1/z Х) = n (1/z Y) = n (1/z R2)























![Нормальная концентрация, т.е. молярная концентрация эквивалента вещества А С[ƒэкв(А)А] или С(1/z А),](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/899606/slide-24.jpg)
![Характеристики стандартного раствора : Нормальная концентрация, т.е. молярная концентрация эквивалента С[ƒэкв(А)А] или](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/899606/slide-25.jpg)



 Нанотехнологии в быту
Нанотехнологии в быту Избранные главы органической стереохимии
Избранные главы органической стереохимии Нефть и её переработка
Нефть и её переработка 8-9-10 химические формулы
8-9-10 химические формулы Применение кислорода
Применение кислорода Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Супер-химия. Викторина
Супер-химия. Викторина Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40 Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  Галогены
Галогены Галогены. Их значение в жизни человека
Галогены. Их значение в жизни человека Соли
Соли Растворение. Экспериментальная работа с веществами
Растворение. Экспериментальная работа с веществами Разложение отходов. 11 класс
Разложение отходов. 11 класс Гидролиз солей
Гидролиз солей Алкилкарбон қышқылдарының тұздарын алу
Алкилкарбон қышқылдарының тұздарын алу Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков Фепромарон. Химическое название
Фепромарон. Химическое название Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение Биосинтез фенольных соединений в растениях
Биосинтез фенольных соединений в растениях Презентация на тему Фуллерены и нанотрубки
Презентация на тему Фуллерены и нанотрубки  Ионы. Катионы и анионы
Ионы. Катионы и анионы Исследование n-метилольных производных аллантоина методом тонкослойной хроматографии
Исследование n-метилольных производных аллантоина методом тонкослойной хроматографии Реакция полимеризации
Реакция полимеризации Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс
Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Химия в быту
Химия в быту Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты