Содержание
- 2. Фосфор P – химический элемент V группы периодической системы Менделеева атомный номер 15, атомная масса 30,973762(4).
- 3. Фосфор в природе Фосфор относится к числу распространенных элементов. Общее содержание в земной коре составляет около
- 4. Получение Фосфор получают из измельченных фосфоритов и апатитов, последние смешиваются с углем и песком и прокаливаются
- 5. Применение Красный фосфор применяется при изготовлении спичек (см. рисунок). Он входит в состав смеси, наносимой на
- 7. Скачать презентацию
Слайд 2Фосфор P – химический элемент V группы периодической системы Менделеева атомный номер
Фосфор P – химический элемент V группы периодической системы Менделеева атомный номер

15, атомная масса 30,973762(4). Фосфор – неметалл. В соединениях он обычно проявляет степень окисления +5, реже – +3 и –3 (только в фосфидах).
Слайд 3Фосфор в природе
Фосфор относится к числу распространенных элементов. Общее содержание в земной
Фосфор в природе
Фосфор относится к числу распространенных элементов. Общее содержание в земной

коре составляет около 0,08%. Вследствие лёгкой окисляемости фосфор в природе встречается только в виде соединений. Главными минералами фосфора являются фосфориты и апатиты, из последних наиболее распространён фторапатит 3Ca3(PO4)2 • CaF2. Фосфор – необходимый элемент живых организмов. Он присутствует в костях, мышцах, в мозговой ткани и нервах. Из фосфора построены молекулы АТФ – аденозинтрифосфорной кислоты (АТФ – собиратель и носитель энергии). В организме взрослого человека содержится в среднем около 4,5 кг фосфора, в основном в соединении с кальцием.
Фосфор содержится также в растениях.
Природный фосфор состоит лишь из одного стабильного изотопа 31Р. В наши дни известно шесть радиоактивных изотопов фосфора.
Фосфор содержится также в растениях.
Природный фосфор состоит лишь из одного стабильного изотопа 31Р. В наши дни известно шесть радиоактивных изотопов фосфора.
Слайд 4Получение
Фосфор получают из измельченных фосфоритов и апатитов, последние смешиваются с углем и
Получение
Фосфор получают из измельченных фосфоритов и апатитов, последние смешиваются с углем и

песком и прокаливаются в печах при 1500°С:
2Ca3(PO4)2 + 10C + 6SiO2 6CaSiO3 + P4↑ + 10CO↑.
Фосфор выделяется в виде паров, которые конденсируются в приёмнике под водой, при этом образуется белый фосфор.
При нагревании до 250-300°С без доступа воздуха белый фосфор превращается в красный.
Чёрный фосфор получается при длительном нагревании белого фосфора при очень большом давлении (200°С и 1200 МПа).
2Ca3(PO4)2 + 10C + 6SiO2 6CaSiO3 + P4↑ + 10CO↑.
Фосфор выделяется в виде паров, которые конденсируются в приёмнике под водой, при этом образуется белый фосфор.
При нагревании до 250-300°С без доступа воздуха белый фосфор превращается в красный.
Чёрный фосфор получается при длительном нагревании белого фосфора при очень большом давлении (200°С и 1200 МПа).
Слайд 5Применение
Красный фосфор применяется при изготовлении спичек (см. рисунок). Он входит в состав
Применение
Красный фосфор применяется при изготовлении спичек (см. рисунок). Он входит в состав

смеси, наносимой на боковую поверхность спичечного коробка. Основным компонентом состава головки спички является бертолетова соль KClO3. От трения головки спички о намазку коробка частицы фосфора на воздухе воспламеняются. В результате реакции окисления фосфора выделяется тепло, приводящее к разложению бертолетовой соли. Фосфор используют в металлургии. Он применяется для получения проводников и входит в состав некоторых металлических материалов, например оловянных бронз.
Также фосфор используют при производстве фосфорной кислоты и ядохимикатов (дихлофос, хлорофос и др.).
Белый фосфор используют для создания дымовых завес, так как при его горении образуется белый дым.
Также фосфор используют при производстве фосфорной кислоты и ядохимикатов (дихлофос, хлорофос и др.).
Белый фосфор используют для создания дымовых завес, так как при его горении образуется белый дым.
- Предыдущая
Замедление времени. 10 класс Характеристика элемента по положению в таблице Д.И.Менделеева
Характеристика элемента по положению в таблице Д.И.Менделеева Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Учебная мотивация как показатель качества образования (на уроках химии)
Учебная мотивация как показатель качества образования (на уроках химии) Образование и получение веществ. 6 класс
Образование и получение веществ. 6 класс Термокаталитические процессы переработки нефтяных фракций
Термокаталитические процессы переработки нефтяных фракций Кислоты. Что нас объединяет?
Кислоты. Что нас объединяет? Аймақтық мета морфизм тауж ыныстары
Аймақтық мета морфизм тауж ыныстары Природные источники углеводорода
Природные источники углеводорода Презентация на тему Применение спиртов
Презентация на тему Применение спиртов  Идеальный газ
Идеальный газ Примеры карбоновых кислот
Примеры карбоновых кислот Презентация на тему Галогены и их соединения
Презентация на тему Галогены и их соединения 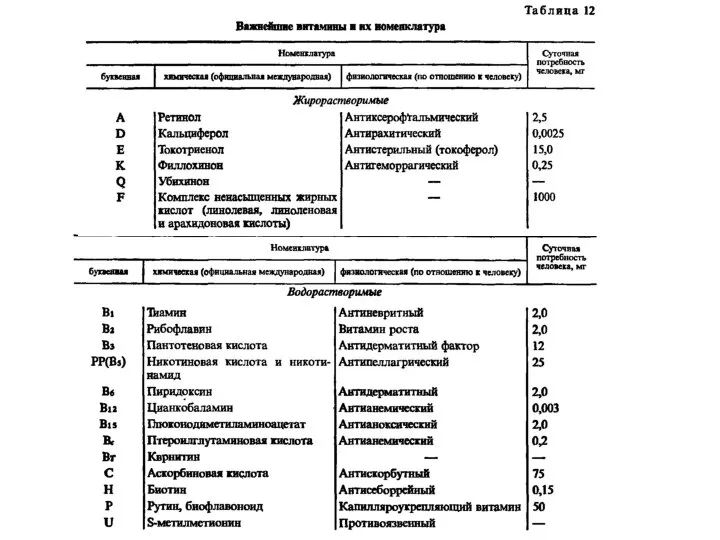 Важнейшие витамины и их номенклатура
Важнейшие витамины и их номенклатура Неорганические основания
Неорганические основания Основные понятия и законы химии
Основные понятия и законы химии Алкины
Алкины Теоретические основы аналитичесой химии. Общие понятия
Теоретические основы аналитичесой химии. Общие понятия Презентация на тему Строение атома
Презентация на тему Строение атома  Галогены. Возможные степени окисления
Галогены. Возможные степени окисления e169ef73a24f42198b95276fd042e8b8
e169ef73a24f42198b95276fd042e8b8 Химическое равновесие
Химическое равновесие Задача на химическое равновесие
Задача на химическое равновесие Закон сохранения массы и химические уравнения
Закон сохранения массы и химические уравнения Оксиды
Оксиды Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Металлы и неметаллы
Металлы и неметаллы Презентация на тему Нефть. Переработка нефти
Презентация на тему Нефть. Переработка нефти