Презентация по Химии "Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»"
Содержание
- 3. Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит» Задачи урока: Познакомиться с понятиями: ОВР, окисление, восстановление,
- 4. Входной контроль 1 вариант 1 - Г 2 - А 3 – Г 4 – А
- 5. Лабораторная работа А) Проведите химические реакции Взаимодействия железа с сульфатом меди Взаимодействия растворов сульфата меди и
- 6. Fe0+Cu+2 SO4 = Fe SO4 + Сu +2 0 Суть ОВР – переход электронов от одних
- 7. Какие два процесса происходят в ОВР? Fe0 + Cu+2SO4 = Cu0 + Fe+2SO4 Fe0 → Fe+2
- 8. Окислитель Восстановитель Fe Cu+2
- 9. Внимание!!! Самостоятельная работа...
- 10. Уэ-1 Значение ОВР ОВР обеспечивают жизненно важные процессы организмов. Используются для получения различных веществ; для теплообеспечения
- 11. УЭ-2 Распознавание ОВР по химическим уравнениям Окислительно-восстановительную реакцию можно определить по изменению степени окисления у отдельных
- 12. УЭ-3 Процессы окисления и восстановления. 1. А) окисление (ок-ие),восстановитель (в-ль) Б) восстановление (в-ие), окислитель (ок-ль) В)
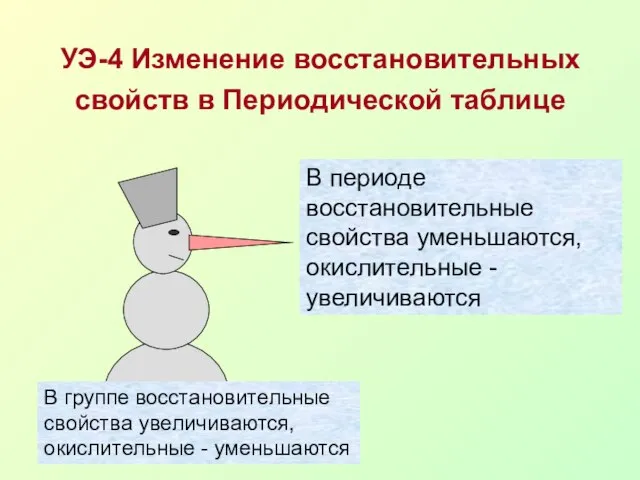
- 13. УЭ-4 Изменение восстановительных свойств в Периодической таблице В периоде восстановительные свойства уменьшаются, окислительные - увеличиваются В
- 14. УЭ-4 Изменение восстановительных свойств в Периодической таблице 2. а) Li, Na, K б) S, Si, Na
- 15. Выходной контроль 1 - Б 2 - Б 3 - В 4 - А 5 -
- 16. 1 Вариант С0 + О20 = С+4О2-2 C0 - 4e = C+4 - ок-ие, в-ль O0
- 17. Домашнее задание Стр. 229-231, выучить определения. Стр.235. упр 1( «3») упр 1,3 («4») упр 1, 3,
- 18. Закончите схемы процессов, укажите окислитель и восстановитель: Na …… = Na+ S-2 …… = S0 S-2
- 19. выводы: 1)овр чрезвычайно распространены; 2)суть овр-переход электронов от одних атомов,молекул или ионов к другим; 3)овр-единство двух
- 20. е Окислительно-восстановительные реакции в природе и жизни человека: 1. Фотосинтез 2.Реакции круговорота веществ в природе 3.
- 21. 2KMnO4 = K2MnO4 + MnO2 + O2 2) Cu(OH)2 = CuO + H2O
- 23. Скачать презентацию


















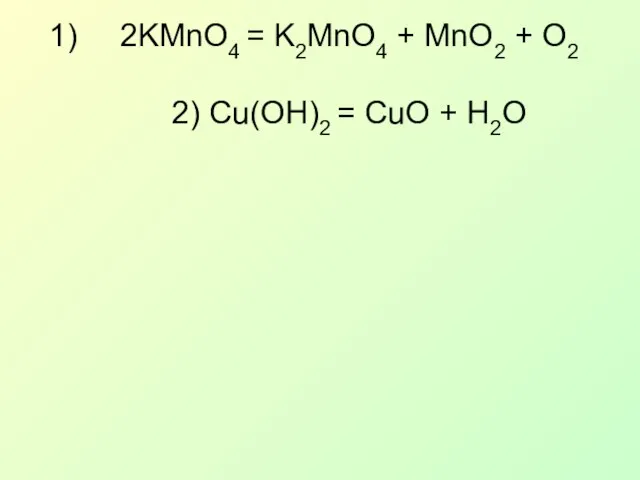
 Химические равновесия в растворах. Лекция 2. Часть 1
Химические равновесия в растворах. Лекция 2. Часть 1 Как искупаться дома в морской воде?
Как искупаться дома в морской воде? Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу
Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу Протолитическая теория кислот и оснований. Буферные растворы
Протолитическая теория кислот и оснований. Буферные растворы Determination of optical properties of pentacoordinated silicon complexes using DFT method
Determination of optical properties of pentacoordinated silicon complexes using DFT method Малотоннажные термопласты
Малотоннажные термопласты Строение атома
Строение атома Презентация на тему Применение кислорода
Презентация на тему Применение кислорода  Химические знания - в жизнь. Основы нутрициологии
Химические знания - в жизнь. Основы нутрициологии Peek. Сферы применения
Peek. Сферы применения Типы химических реакций
Типы химических реакций Svins. Iegūšana
Svins. Iegūšana Применение серы, хлора, углерода
Применение серы, хлора, углерода Радиоакивные металлы
Радиоакивные металлы Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения Алкины
Алкины Кислоты, их состав и название
Кислоты, их состав и название Мезомерный эффект
Мезомерный эффект Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Сера
Сера Моделирование фазовых систем. Тройные взаимные системы
Моделирование фазовых систем. Тройные взаимные системы Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Презентация на тему Эфиры и жиры
Презентация на тему Эфиры и жиры  Металлы. Контрольная работа
Металлы. Контрольная работа Получение армированных фотополимерных композиций
Получение армированных фотополимерных композиций Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Презентация на тему Карбонаты
Презентация на тему Карбонаты 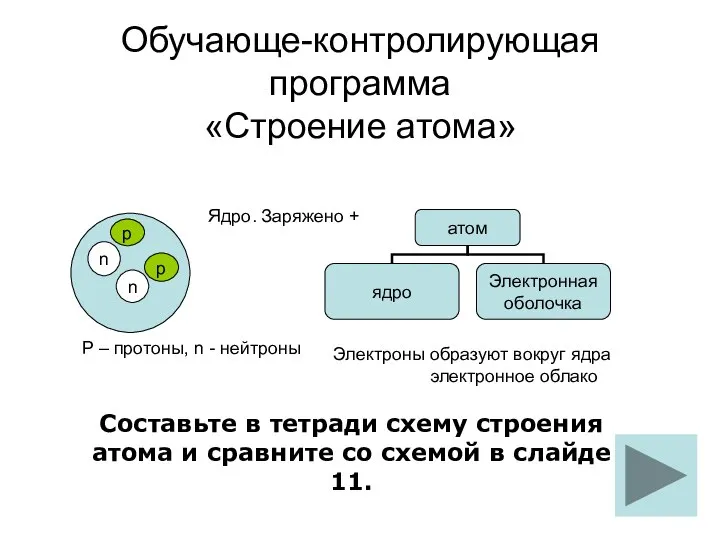 строение атома обуч-контр прогр
строение атома обуч-контр прогр