Содержание
- 2. Задания для 10 класса I уровень 1. Сульфат содержит 23,35% калия. 1. Определите формулу сульфата. (5
- 3. Решение. 1. В общем виде уравнение электронейтральности будет выглядеть следующим образом: где n(Эi) - степень окисления
- 4. 0,5973 + 0,1871х – 0,1251(76,65 - х) = 0 0,3122х = 8,9917 х = 28,8 Таким
- 5. 2. Строение аниона:
- 6. 3. При растворении K2S3О10 в воде происходит превращение трисульфата в сульфат и выделение серной кислоты: K2S3O10
- 7. 2. Известны мольные теплоты сгорания (Q) первых шести членов нормального ряда алканов (CnH2n+2) с неразветвленной углеродной
- 8. 1. Построим график зависимости Q от n: Имеет место линейная зависимость Q = An + B,
- 10. II уровень 3. На смесь массой 71,70 г, состоящей из оксида натрия, оксида кальция и диоксида
- 11. Решение. 1. ОПРЕДЕЛИМ СОСТАВ СМЕСИ ОКСИДОВ: NA2O + 2HCL = 2NACL + H2O, CAO + 2HCL
- 12. В растворе фторидной кислоты протекают реакции: NA2O + 2HF = 2NAF + H2O, CAO + 2HF
- 13. 3. Жидкий HF состоит из полимерных цепей (HF)n различной длины, а также некоторого количества димеров H2F2
- 14. 4. Причиной отсутствия у фтора кислоты состава HГОn и неустойчивости кислородных соединений фтора, как и всех
- 15. 5. В степени окисления +7 хлор образует кислоту НСlO4, бром - НВrO4, иод - Н5IO6. Структура
- 16. 6. При нагревании до 1200°С, а затем охлаждении до комнатной температуры исходной смеси оксидов образуется стекло.
- 17. 10 клас II уровень 4. В прозрачный сосуд (1) объемом 2,00 л поместили при 20°С а
- 18. Решение: 1-2. Формулы газообразных простых веществ и их молекулярная масса (за исключением благородных газов): Мr(Н2) =
- 19. После реакции давление в сосуде (1) упало практически до нуля, поэтому СХНY не может быть алканом
- 20. 3. Радикальное присоединение (AR). 4. Ароматическая π-система бензола энергетически очень выгодна – на разрушение требуются большие
- 21. III уровень Многотоннажное промышленное производство основано на обратимой реакции X2 + 3Y2 ⇄ 2XY3 (∆H 1.
- 22. Решение: 1. Речь идет о реакции получения аммиака: N2 + 3H2 ⇄ 2NH3. Этот процесс реализуется
- 23. k1[А]m[В]n = k2[C]p[D]q или K = k1/k2 = ([C]p[D]q)/([А]m[В]n). 4. а) если увеличить давление в реакторе,
- 24. 11 класс I уровень 1. В соединении CaX2Y2 массовая доля кальция равна 28,0%, а в соединении
- 25. Решение. 1. Пусть М(CaX2Y2) = 40 + 2х + 2у, М(CaXY2) = 40 + х +
- 26. 2. Некоторое вещество характеризуется следующими свойствами: может растворяться в воде и спирте; реагирует с аммиачным раствором
- 27. Решение. 1. a) ν(MnO4−) = 0,0256∙0,05 = 1,28∙10-3 (моль) νЭКВ(МnO4−) = 1,28∙10-3∙5 = 6,4∙10-3 (моль), νЭКВ(Х)
- 28. Молярная масса X в таком случае составит М = МЭКВ:ƒ = 56 (г/моль). Для процесса окисления
- 29. 2. NaHS + 2[Ag(NH3)2]OH = Ag2S↓ + 4NH3 + NaOH + H2O NaHS + Br2 =
- 30. 11 класс 3. При нитровании хлорбензола смесью концентрированных азотной и серной кислот при нагревании происходит образование
- 31. Решение: Исходя из наличия в А трех типов атомов водорода можно сделать вывод, что при данных
- 32. Разница в соотношении обоих веществ в разных растворителях определяется тем, что в растворе существует равновесие: С2Н5ОН
- 33. 4. Реакция взаимодействия этилового спирта и уксусной кислоты является реакцией второго порядка. Для проведения реакции смешали
- 34. Решение. 1. С2Н5ОН + СН3СООН = СН3СООС2Н5 + Н2О 2. с(к-ты) = с(спирта) = 1 моль/л
- 35. 11 класс 5. Соединение А состава С4Н8О реагирует с водным раствором перманганата калия, бромной водой и
- 36. Решение: 1. Вещества состава С4Н8О принадлежат к гомологическим рядам СnН2nО и должны иметь либо двойную связь
- 38. Скачать презентацию
Слайд 2Задания для 10 класса
I уровень
1. Сульфат содержит 23,35% калия.
1. Определите формулу сульфата.
Задания для 10 класса
I уровень
1. Сульфат содержит 23,35% калия.
1. Определите формулу сульфата.

2. Приведите строение его аниона. (5 баллов)
3. Определите состав раствора в масс. %, полученного при растворении 66,8 г сульфата в 250 мл воды. (5 баллов)
Слайд 3Решение.
1. В общем виде уравнение электронейтральности будет выглядеть следующим образом:
где n(Эi) -
Решение.
1. В общем виде уравнение электронейтральности будет выглядеть следующим образом:
где n(Эi) -

Кроме того, ω(S) = х%, ω(О) = 100 – 23,35 – х = 76,65 – х.
Слайд 40,5973 + 0,1871х – 0,1251(76,65 - х) = 0
0,3122х = 8,9917
х =
0,3122х = 8,9917
х =

Таким образом, ω(K) = 23,35%, ω(S) = 28,89%, ω(О) = 47,85%.
При условии, что нам дано 100 г сульфата, m(K) = 23,35 г, m(S) = 28,89 г, m(О) = 47,85 г.
ν(K) = 0,6 моль, ν(S) = 0,9 моль, ν(О) = 3 моль. ν(K):ν(S):ν(О) = 0,6:0,9:3 = 2:3:10.
Формула сульфата: K2S3О10.
Слайд 52. Строение аниона:
2. Строение аниона:
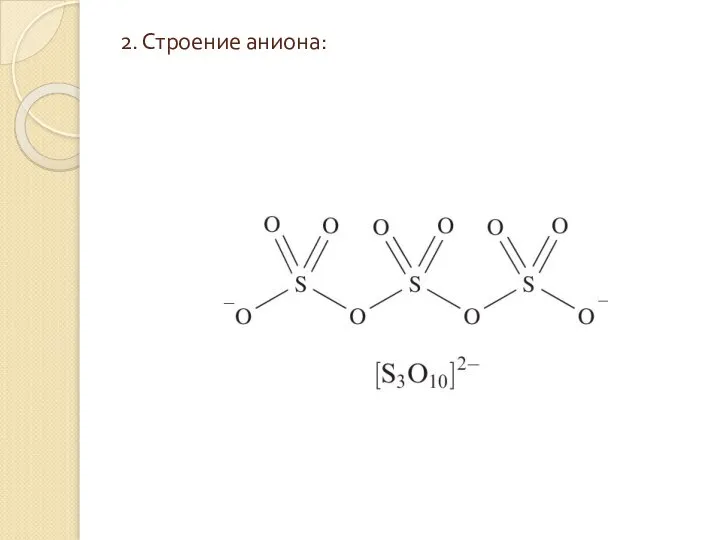
Слайд 63. При растворении K2S3О10 в воде происходит превращение трисульфата в сульфат и
3. При растворении K2S3О10 в воде происходит превращение трисульфата в сульфат и

ν(K2S3О10) = 66,8/334 = 0,2 моль, тогда ν(K2SО4) = 0,2 моль, ν(Н2SО4) = 0,4 моль.
m(K2SО4) = 0,2·174 = 34,8 г, m(Н2SО4) = 0,4·98 = 39,2 г.
Состав раствора: ω(K2SО4) = 34,8/316,8 = 0,1098, ω(Н2SО4) = 39,2/316,8 = 0,1237.
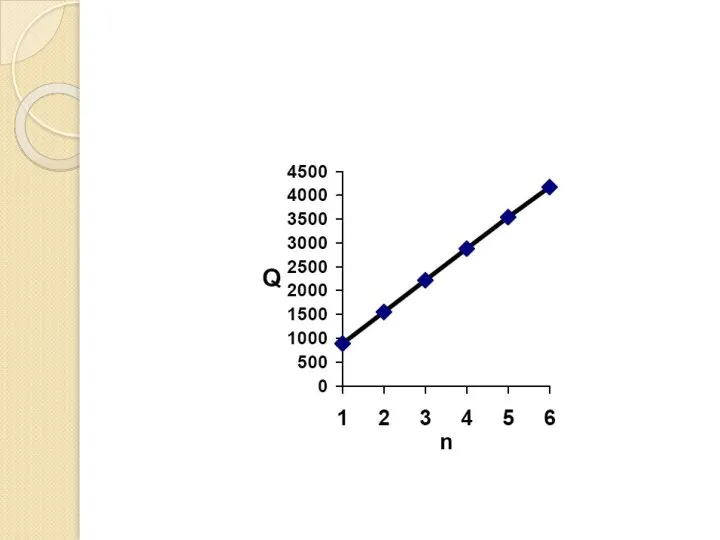
Слайд 72. Известны мольные теплоты сгорания (Q) первых шести членов нормального ряда алканов
2. Известны мольные теплоты сгорания (Q) первых шести членов нормального ряда алканов

1. Выведите зависимость Q от n. (5 баллов)
2. Выведите формулу, которая выражает мольные теплоты сгорания алканов, через энергии связей С–H, C–C, O–H, O=O, C=O и значение n, и служит теоретическим обоснованием установленной Вами зависимости. (5 баллов)
3. Рассчитайте мольную теплоту сгорания н-декана. Рассчитайте абсолютную и относительную ошибки полученного Вами значения, если известно, что экспериментально определенная величина теплоты сгорания н-декана равна -6855,5 кДж/моль. (5 баллов)
Всего 15 баллов
Слайд 81. Построим график зависимости Q от n:
Имеет место линейная зависимость Q =
1. Построим график зависимости Q от n:
Имеет место линейная зависимость Q =

2. CnH2n+2 + [(3n+1)/2]O2 = nCO2 + (n+1)H2O.
Выразим мольную теплоту сгорания через мольные энергии связей (E):
Q = 2nE(C=O) + (2n+2)E(O–H) - (n-1)E(C–C) - (2n+2)E(C–H) - [(3n+1)/2]E(O=O).
Отсюда Q = n{2E(C=O) + 2E(O–H) - 2E(C–H) - E(C–C) - 3/2E(O=O)} + {2E(O–H) + E(C–C) – 2E(C–H) - 1/2E(O=O)}. (1)
При выводе формулы использовали предположение, что при переходе от одного алкана нормального ряда к другому энергии связей С-Н, С-С неизменны.
3. Мольная теплота сгорания н-гексадекана С16Н34 Q = 16·662,9 + 226,5 = 10832,9 (кДж/моль).
Абсолютная погрешность Δ = 10832,9 - 10709,2 = 123,7 (кДж/моль),
относительная погрешность δ = [123,7/10709,2]·100% = 1,16%.
Слайд 10II уровень
3. На смесь массой 71,70 г, состоящей из оксида натрия, оксида
II уровень
3. На смесь массой 71,70 г, состоящей из оксида натрия, оксида

1. Рассчитайте массу 40%-го раствора фторидной кислоты, которая необходима для взаимодействия с исходной смесью оксидов. (8 баллов)
2. Объясните изменение температур кипения в ряду галогенводородов HF (19,5°С), HCl (-85,1°С), HBr (-66,8°С), HI (-50,9°С). (3 балла)
3. Опишите строение фтороводорода в жидком состоянии и объясните образование кислых солей фторидной кислотой. (4 балла)
4. Объясните, почему фтор, в отличие от хлора, брома и иода, не образует кислоты состава HГОn. (1 балл)
5. Приведите формулы кислот галогенов в степени окисления +7 и объясните причину их отличия. (2 балла)
6. Опишите структуру материала, который образуется при нагревании до 1200°С, а затем охлаждении до комнатной температуры исходной смеси оксидов. (2 балла)
Слайд 11Решение.
1. ОПРЕДЕЛИМ СОСТАВ СМЕСИ ОКСИДОВ:
NA2O + 2HCL = 2NACL + H2O,
CAO +
Решение.
1. ОПРЕДЕЛИМ СОСТАВ СМЕСИ ОКСИДОВ:
NA2O + 2HCL = 2NACL + H2O,
CAO +

SIO2 + HCL =/= РЕАКЦИЯ НЕ ИДЕТ.
НЕРАСТВОРИВШИЙСЯ ОСТАТОК - SIO2. M(SIO2) = 54 Г, ν(SIO2) = 54/60 = 0,9 МОЛЬ.
МАССА NA2O + CAO СОСТАВЛЯЕТ 71,70 – 54 = 17,70 Г.
ПУСТЬ ν(NA2O) = Х МОЛЬ, ν(САО) = У МОЛЬ. ТОГДА ν(NACL) = 2Х МОЛЬ, ν(CACL2) = У МОЛЬ.
СОСТАВЛЯЕМ СИСТЕМУ УРАВНЕНИЙ:
62Х + 56У = 17,70
58,5·2Х + 111У = 34,20
РЕШЕНИЕМ СИСТЕМЫ ЯВЛЯЕТСЯ: Х = 0,15; У = 0,15; ν(NA2O) = 0,15 МОЛЬ, ν(САО) = 0,15 МОЛЬ.
Слайд 12В растворе фторидной кислоты протекают реакции:
NA2O + 2HF = 2NAF + H2O,
CAO
NA2O + 2HF = 2NAF + H2O,
CAO

SIO2 + 6HF (КОНЦ.) = H2[SIF6] + 2H2O.
ν(HF) = 0,15·2 + 0,15·2 + 0,9·6 = 6 МОЛЬ. M(HF) = 6·20 = 120 Г.
M(HF)Р-Р = 120/0,4 = 300 Г.
2. Температуры кипения в ряду галогенводородов HCl - HBr - HI последовательно возрастают, что объясняется ростом массы и размеров молекул, из-за чего усиливается межмолекулярное взаимодействие и, как следствие, повышаются температуры плавления и кипения. Однако для HF значения температур плавления и кипения, полученные экстраполяцией в ряду однотипных соединений HF – НСl – НВr – HI, оказываются существенно ниже найденных экспериментально. Аномально высокие температуры плавления и кипения фтороводорода объясняются усилением межмолекулярного взаимодействия за счет образования водородных связей между молекулами HF. Твердый фтороводород состоит из зигзагообразных полимерных цепей. В жидком и газообразном HF вплоть до 57°С присутствуют олигомеры от (HF)2 до (HF)6. Для НСl, HBr, HI образование водородных связей не характерно из-за меньшей электроотрицательности атома галогена.
Слайд 133. Жидкий HF состоит из полимерных цепей (HF)n различной длины, а также
3. Жидкий HF состоит из полимерных цепей (HF)n различной длины, а также

Высокая диэлектрическая проницаемость жидкого фтороводорода (ε = 83,6 при 0°С), низкая вязкость и широкий температурный интервал жидкою состояния делают его хорошим неводным растворителем для большого числа соединений.
Образованием водородных связей объясняется существование кислых фторидов (или гидрофторидов), не имеющих аналогов среди солей, производных других галогеноводородных кислот. В гидрофторидах, например в NH4HF2 анион HF2− содержит два иона фтора, соединенных симметричной водородной связью, т.е. оба расстояния Н-F в группировке F···H-F одинаковы. Это довольно редкое явление: как правило, водородные связи не симметричны.
Гидрофториды имеют относительно низкую температуру плавления. Так, KHF2 плавится при ~200°С, а средняя соль KF - при ~700°С. Низкая температура плавления гидрофторидов ЩЭ - причина их практической важности для технологии. Например, при электролизе расплавов фторидов с целью получения молекулярного фтора экономически целесообразно использовать KHF2 или KH2F3, а не KF.
Слайд 144. Причиной отсутствия у фтора кислоты состава HГОn и неустойчивости кислородных соединений
4. Причиной отсутствия у фтора кислоты состава HГОn и неустойчивости кислородных соединений

Положение усугубляется еще и тем, что фтор не способен образовывать кратные связи, в том числе с кислородом, из-за отсутствия у фтора свободных орбиталей, и поэтому кислород не может, реагируя со фтором, реализовать свою склонность к двоесвязанности. К тому же одинарные ковалентные связи, в которые вступает кислород (например, связь О-О в Н2О2), непрочны. Реагируя с другими соседями по периоду, тоже высокоэлектроотрицательными азотом и углеродом, кислород образует с ними кратные связи, благодаря наличию у N и С не полностью занятых электронами 2р–орбиталей. Это объясняет значительно большую прочность кислородных соединений азота и углерода по сравнению с такими же соединениями галогенов, особенно фтора.
Слайд 155. В степени окисления +7 хлор образует кислоту НСlO4, бром - НВrO4,
5. В степени окисления +7 хлор образует кислоту НСlO4, бром - НВrO4,

Общая формула гидроксидов – Э–(ОН)Х, где х – степень окисления элемента. Максимальное значение х = 8, однако координационные сферы с большим числом гидроксогрупп неустойчивы. Повышение устойчивости достигается путем уменьшения координационного числа за счет отщепления одной или нескольких молекул воды. Чем выше степень окисления элемента, а следовательно, меньше размер иона, тем большее число молекул воды отщепляется для обеспечения устойчивости координационной сферы. Если для гидроксида хлора устойчивой является структура Сl(ОН)7 – 3Н2О = НСlO4, для гидроксида иода характерно увеличение количества связанных гидроксоанионов, что обусловлено достаточно большим атомным радиусом иода. Для р-элементов 5-го периода вообще характерны более богатые водой гидратные формы. Так, наряду с Н2ТеО4 известна и ортотеллуровая кислота Н6ТеО6 (Те(ОН)6 без потери молекул воды), а для иода кроме НIО4 известна и Н5IО6 с потерей всего 1 молекулы воды от гидроксида номинального состава I(ОН)7.
Слайд 166. При нагревании до 1200°С, а затем охлаждении до комнатной температуры исходной
6. При нагревании до 1200°С, а затем охлаждении до комнатной температуры исходной

Стекло представляет собой однородную систему, аналогичную истинному раствору. Это переохлажденная жидкость с «замороженной» структурой. Иногда стекла называют аморфными веществами, но в отличие от настоящих аморфных веществ в них имеется некоторая упорядоченность в расположении кремнекислородных тетраэдров. Однако структура стекла, в отличие от структуры кристалла, не симметрична и не периодична, поэтому стекла рентгеноаморфны.
Стекла представляют собой неравновесные системы, поскольку образуются путем переохлаждения расплавов. Запас энергии стеклообразной системы больше, чем кристаллической, поэтому в благоприятных температурных условиях стекла способны к кристаллизации. Чем больше способность к самопроизвольной кристаллизации, тем более быстрое охлаждение приходится применять, чтобы перевести расплав в стеклообразное состояние.
Стеклообразное состояние является промежуточным между кристаллическим и жидким. Стекла, в отличие от кристаллических веществ, не имеют определенной температуры плавления и затвердевают постепенно.
Основу структуры силикатного стекла составляют тетраэдры [SiO4]. Как и в кристаллических силикатах, они связаны друг с другом через общие кислородные атомы. В стекле каждый атом имеет определенное число ближайших соседей, т.е. содержатся те или иные структурные единицы. Однако структурная единица регулярно не повторяется. В натриевом стекле ионы натрия размещаются в пустотах стеклообразной структуры, преимущественно вблизи от атомов кислорода, связанных только с одним атомом кремния. Таким образом компенсируется координационная ненасыщенность последних. Каждый ион натрия окружен в среднем шестью атомами кислорода. Ионы натрия в каркасе стекла распределены статистически.
Слайд 1710 клас
II уровень
4. В прозрачный сосуд (1) объемом 2,00 л поместили при
10 клас
II уровень
4. В прозрачный сосуд (1) объемом 2,00 л поместили при

При расчетах пренебречь давлением паров твердых веществ при 20°С и отклонением свойств газов от идеальных.
1. Установите вещества А и Б, а также их массы (а и б). (8 баллов)
2. Укажите, какое органическое вещество (В) образовалось в реакции? Назовите его и приведите уравнение реакции. (3 бала)
3. Приведите механизм реакции образования вещества В. Укажите тип реакции (3 балла)
4. Объясните, почему вещества А и Б не реагируют в темноте даже при 100°С? (2 балла)
5. Возможно ли взаимодействие А и Б с образованием других веществ? Если да, то укажите условия реакции, ее тип, приведите уравнение реакции и механизм процесса. (2 бала)
6. Укажите, каким способом в настоящее время получают углеводород А в промышленности? (1 балл)
7. Какое применение нашло вещество В? Какова причина его высокой биологической активности? (1 балл)
Слайд 18Решение:
1-2. Формулы газообразных простых веществ и их молекулярная масса (за исключением благородных
Решение:
1-2. Формулы газообразных простых веществ и их молекулярная масса (за исключением благородных

Наиболее легкие углеводороды, жидкие при 20°С, содержат 5 атомов С в молекуле, значит, молекулярная масса простого вещества (минимальная) может быть (1,0±0,1)(12·5 + 1у), где у – число атомов водорода. Для изопрена Мr = 12·5 + 8 = 68, Мr(пр.в.) ≈ 68 ± 10% = 68 ± 7. Подходит только хлор. Отсюда: Мr(СХНY) = 71 ± 7,1, 63,9 ≤ Мr(СХНY) ≤ 78,1, х = 5 или 6.
Слайд 19После реакции давление в сосуде (1) упало практически до нуля, поэтому СХНY
После реакции давление в сосуде (1) упало практически до нуля, поэтому СХНY

С6Н6(А) + 3Cl2(Б) –(УФ)→ C6Н6Cl6 (В) (1,2,3,4,5,6-гексахлорциклогексан)
При 100°С и р = 1 атм и бензол, и хлор находились в газовой фазе, поэтому:
n = PV/RT = 1·2 атм·л·моль·K/0,082 л·атм·373 K = 0,0653 моль
а = 0,25n·78,1 = 1,28 г
б = 0,75n·70,9 = 3,48 г
Слайд 203. Радикальное присоединение (AR).
4. Ароматическая π-система бензола энергетически очень выгодна – на
3. Радикальное присоединение (AR).
4. Ароматическая π-система бензола энергетически очень выгодна – на

5. Да. В присутствии кислот Льюиса, например, хлорида алюминия (катализатор) идет реакция электрофильного замещения (SE)
6. Из каменноугольной смолы при коксовании угля и из продуктов риформинга (нагревание бензиновых фракций в присутствии платины, при котором происходят дегидроциклизация алканов и последующая ароматизация циклоалканов).
7. Сильный инсектицид. Полагают, что он является антиметаболитом мезо-инозита, относящегося к витаминам группы В.
Слайд 21III уровень
Многотоннажное промышленное производство основано на обратимой реакции X2 + 3Y2 ⇄
III уровень
Многотоннажное промышленное производство основано на обратимой реакции X2 + 3Y2 ⇄

1. Расшифруйте уравнение реакции и укажите, на каком производстве оно используется. (2 балла)
2. Напишите выражения для скоростей прямой и обратной реакций. (4 балла)
3. Выведите выражение для соотношения констант скоростей прямой и обратной реакции в момент, когда они протекают с одинаковой скоростью. Как называется это соотношение? (4 балла)
4. Как изменится выход продукта реакции, если: а) увеличить давление в реакторе; б) добавить дополнительное количество катализатора. (4 балла)
5. Объясните, почему в промышленных условиях данную реакцию проводят при высокой температуре, несмотря на то, что ∆H<0. (4 балла)
6. Продукт данной реакции служит исходным сырьем для получения важной минеральной кислоты. Приведите уравнения реакций, которые лежат в основе получения этой кислоты. (10 баллов)
7. Элементы X и Y образуют между собой и другие соединения. Назовите эти соединения и приведите их строение. (4 балла)
Слайд 22Решение:
1. Речь идет о реакции получения аммиака: N2 + 3H2 ⇄ 2NH3.
Решение:
1. Речь идет о реакции получения аммиака: N2 + 3H2 ⇄ 2NH3.

2. Скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ.
Выражения для скоростей прямой и обратной реакций для реакции mА + nB ⇄ pC + qD, v1 = k1[А]m[В]n, v2 = k2[C]p[D]q.
Слайд 23k1[А]m[В]n = k2[C]p[D]q или K = k1/k2 = ([C]p[D]q)/([А]m[В]n).
4. а) если увеличить
k1[А]m[В]n = k2[C]p[D]q или K = k1/k2 = ([C]p[D]q)/([А]m[В]n).
4. а) если увеличить
![k1[А]m[В]n = k2[C]p[D]q или K = k1/k2 = ([C]p[D]q)/([А]m[В]n). 4. а) если](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/958409/slide-22.jpg)
б) добавление дополнительного количества катализатора не будет влиять на выход продукта реакции, катализатор ускоряет достижение состояния равновесия, т.е. ускоряет и прямую и обратную реакции.
5. Поскольку реакция N2 + 3Н2(Г) ⇄ 2NH3(Г) + 91,8 кДж экзотермическая, то, исходя из принципа Ле Шателье, ясно, что чем ниже температура процесса, тем больше равновесное состояние будет сдвигаться в сторону образования аммиака и можно предположить, что следует максимально понижать температуру. Но в действительности все обстоит сложнее: при низких температурах реакция протекает очень медленно (практически не идет), поэтому приходится принимать компромиссное решение. Поскольку для установления оптимального состояния равновесия реакции требуется низкая температура, а для достижения удовлетворительной скорости - высокая, на практике процесс проводят при температуре 500°С.
6. А) 4NH3 + 5O2 = 4NO + 6Н2O (800°С, КАТ. PT/RH),
Б) 2NO + O2 = 2NO2 (КОМН.).
В) 4NO2 + O2 + 2Н2O (РАЗБ. HNO3, ГОР.) = 4HNO3 (КОНЦ.).
7. Другие соединения азота с водородом: гидразин - N2H4 и азидоводород - HN3.
Слайд 24
11 класс
I уровень
1. В соединении CaX2Y2 массовая доля кальция равна 28,0%, а
11 класс
I уровень
1. В соединении CaX2Y2 массовая доля кальция равна 28,0%, а

1. Определите элементы Х и Y. Напишите формулы и назовите указанные соединения. (6 баллов)
2. Укажите степени окисления всех элементов в этих соединениях. (2 балла)
3. Приведите уравнения реакций, которые протекают при нагревании этих соединений. (5 баллов)
4. Объясните, почему соединение CaX2Y2 не следует хранить на воздухе. (2 балла)
Всего 15 баллов
Слайд 25Решение.
1. Пусть М(CaX2Y2) = 40 + 2х + 2у, М(CaXY2) = 40
Решение.
1. Пусть М(CaX2Y2) = 40 + 2х + 2у, М(CaXY2) = 40

Составим систему уравнений:
0,28(40+2х+2у) = 40
0,315(40+х+2у) = 40
решением которой будут: х = 16 (О), у = 35,5 (Cl).
Тогда CaX2Y2 - CaО2Cl2 или Ca(ОCl)2, гипохлорит кальция; CaXY2 - CaОCl2 или Ca(Cl)ОCl гипохлорит-хлорид кальция.
2. Ca+2(О-2Cl+1)2, Ca+2(Cl−)О-2Cl+1.
3. Са(СlO)2 = СаСl2 + О2.
6Ca(OCl)Cl = 5CaCl2 + Ca(ClO3)2.
CaОCl2 = СаСl2 + О2.
4. Са(СlO)2 не следует хранить на воздухе, т.к. это вещество активно поглощает углекислый газ и разлагается под действием солнечного света
Са(СlO)2 + СО2 + Н2О = СаСО3↓ + 2НСlО (комн.)
Са(СlO)2 = СаСl2 + О2 (hν).
Слайд 262. Некоторое вещество характеризуется следующими свойствами:
может растворяться в воде и спирте;
реагирует с
2. Некоторое вещество характеризуется следующими свойствами:
может растворяться в воде и спирте;
реагирует с

обесцвечивает бромную воду и розовый раствор перманганата калия;
окисляется кислородом и реагирует с гидросульфитом натрия.
Если 1,12 г этого вещества растворить в 250 мл воды, то 10 мл этого раствора способно обесцветить 25,6 мл 0,005 М раствора перманганата калия в кислой среде. Такая же аликвота может быть оттитрована 20,0 мл 0,04 М раствора хлороводорода.
1. Определите, что это за вещество. Ответ подтвердите расчетом. (6 баллов)
2. Приведите уравнения реакций, соответствующие условию задачи. (6 баллов)
3. Объясните, можно ли это вещество оттитровать щелочью. (3 балла)
Всего 15 баллов
Слайд 27Решение.
1. a) ν(MnO4−) = 0,0256∙0,05 = 1,28∙10-3 (моль)
νЭКВ(МnO4−) = 1,28∙10-3∙5
Решение.
1. a) ν(MnO4−) = 0,0256∙0,05 = 1,28∙10-3 (моль)
νЭКВ(МnO4−) = 1,28∙10-3∙5

В 1,12 г вещества X содержится 6,4∙10-3∙250/10 = 0,16 (моль) эквивалентов.
МЭКВ(Х) = 1,12/0,16 = 7 (г/моль)
б) ν(HCl) = 0,02∙0,04 = 8∙10-4 (моль), νЭКВ(X) = νЭКВ(HCl) = 8∙10-4 (моль)
В 1,12 г вещества X содержится 8∙10-4∙250/10 = 0,02 (моль) эквивалентов.
МЭКВ(Х) = 1,12/0,02 = 56 (г/моль)
Следовательно, X выступает как в роли восстановителя, так и в роли основания. При этом молярные массы возможных эквивалентов X относятся как:
МЭКВ(осн.):МЭКВ(восст) = М∙ƒОСН:M∙ƒВОССТ = ƒОСН:ƒВОССТ = 56:7 = 8: 1 (где ƒ - фактор эквивалентности)
Единственный реальный вариант: ƒОСН = 1, ƒВОССТ = 1/8.
Слайд 28Молярная масса X в таком случае составит М = МЭКВ:ƒ = 56
Молярная масса X в таком случае составит М = МЭКВ:ƒ = 56

Для процесса окисления можно предположить следующие 8-электронные переходы:
-1 → +7 не реализуется в этих реакциях
-2 → +6 HS− (ат. масса Se > 56)
-3 → +5 NH3 - не окисляется перманганатом
РН3 - не титруется кислотой (ат. масса As > 56)
-4 → +4 СН4? SiН4? (ат. масса Ge > 56)
Если X содержит HS− - ионы, то 56 - 1 - 32 = 23 (г/моль), что совпадает с атомной массой натрия.
Тогда X - NaHS.
Слайд 292.
NaHS + 2[Ag(NH3)2]OH = Ag2S↓ + 4NH3 + NaOH + H2O
NaHS
2.
NaHS + 2[Ag(NH3)2]OH = Ag2S↓ + 4NH3 + NaOH + H2O
NaHS
![2. NaHS + 2[Ag(NH3)2]OH = Ag2S↓ + 4NH3 + NaOH + H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/958409/slide-28.jpg)
5HS− + 8MnO4− + 19H+ = 5SO42- + 8Mn2+ + 12H2O
HS− + Н+ = H2S
2NaHS + 2O2 = Na2S2O3 + H2O
3. Щелочью оттитровать раствор NaHS невозможно, т.к. сероводород по второй стадии диссоциации - очень слабая кислота (KаII = 10-13).
Слайд 3011 класс
3. При нитровании хлорбензола смесью концентрированных азотной и серной кислот при
11 класс
3. При нитровании хлорбензола смесью концентрированных азотной и серной кислот при

1. Изобразите структуры А, В, С и D, укажите качественный состав Е. (10 баллов)
2. Напишите, какое ароматическое соединение будет преобладать в смеси Е при ее получении из: а) В; б) С. (8 баллов)
3. Соединение А в присутствии влаги обладает раздражающим действием на слизистые оболочки. Объясните это явление, ответ подтвердите уравнением реакции. (2 балла)
Всего 20 баллов
Слайд 31Решение:
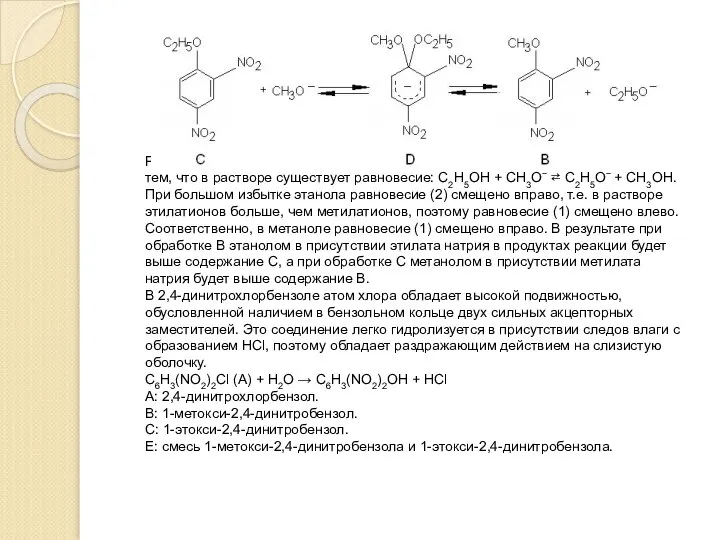
Исходя из наличия в А трех типов атомов водорода можно сделать вывод,
Решение:
Исходя из наличия в А трех типов атомов водорода можно сделать вывод,

Слайд 32Разница в соотношении обоих веществ в разных растворителях определяется тем, что в
Разница в соотношении обоих веществ в разных растворителях определяется тем, что в
Слайд 334. Реакция взаимодействия этилового спирта и уксусной кислоты является реакцией второго порядка.
4. Реакция взаимодействия этилового спирта и уксусной кислоты является реакцией второго порядка.

1. Напишите уравнение реакции этерификации. (4 балла)
2. Определите выход продукта реакции, если после ее протекания концентрация эфира в растворе равна 0,3 моль/л. (8 баллов)
3. Укажите, как можно увеличить выход продукта данной реакции. (3 бала)
4. Зависимость концентрации реагирующих веществ от времени протекания для реакции второго порядка описывается уравнением . Определите время за которое реакция пройдет на 30%, если при некоторой температуре константа скорости реакции равна 1,52 л∙моль-1∙мин-1. (5 баллов)
Всего 20 баллов
Слайд 34Решение.
1. С2Н5ОН + СН3СООН = СН3СООС2Н5 + Н2О
2. с(к-ты) = с(спирта)
Решение.
1. С2Н5ОН + СН3СООН = СН3СООС2Н5 + Н2О
2. с(к-ты) = с(спирта)

3. Сульфатную кислоту добавляют в качестве катализатора и водоотнимающего реагента.
Эта реакция является обратимой. Для того, чтобы осуществить прямую реакцию, то есть получить эфир, нужно удалять воду из реакционной смеси (например, перегонкой).
4.
1/0,3 = 1+1,52τ;
τ = 1,54 мин.
Слайд 3511 класс
5. Соединение А состава С4Н8О реагирует с водным раствором перманганата калия,
11 класс
5. Соединение А состава С4Н8О реагирует с водным раствором перманганата калия,

1. Напишите структурные формулы всех устойчивых ациклических соединений состава С4Н8О. (7 баллов)
2. Выберите из этих изомеров формулы тех соединений, которые будут реагировать со всеми тремя названными реагентами. (7 балов)
3. Установите структурную формулу вещества А. (6 баллов)
4. Напишите схемы описанных в задании превращений. (6 баллов)
5. Предложите несколько способов получения вещества А. (4 балла)
Всего 30 баллов
Слайд 36Решение:
1. Вещества состава С4Н8О принадлежат к гомологическим рядам СnН2nО и должны иметь
Решение:
1. Вещества состава С4Н8О принадлежат к гомологическим рядам СnН2nО и должны иметь

2. Все непредельные соединения 4 - 13 будут реагировать с KМnО4, НВr и Br2 (карбонильные соединения 1 - 3 в присутствии НВr могут вступать в реакции конденсации).
3. Непредельные спирты 4 – 8 и непредельные эфиры 9 - 11, не полностью удовлетворяют условиям задачи в отношении дальнейших превращений продуктов Б, В, Г. Только эфиры 12 и 13 в реакции с KМnО4 образуют полуацетали, претерпевающие дальнейшие превращения:
 Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот Обмен белков и аминокислот. Синтез заменимых аминокислот
Обмен белков и аминокислот. Синтез заменимых аминокислот Загадки химии
Загадки химии Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Белки молока и молочных продуктов. Виды белков
Белки молока и молочных продуктов. Виды белков Занимательная химия в 8 классе
Занимательная химия в 8 классе Полиэтилен-1
Полиэтилен-1 Дека́н (н-декан) — органическое соединение класса алканов
Дека́н (н-декан) — органическое соединение класса алканов Метаболизм чужеродных соединений
Метаболизм чужеродных соединений Классификация оксидов
Классификация оксидов Введение в общую теорию поверхностных явлений. Лекция 1
Введение в общую теорию поверхностных явлений. Лекция 1 Галогены
Галогены Химические уравнения
Химические уравнения Примеры реакций в жизни и в быту
Примеры реакций в жизни и в быту Природный и попутный газы, их состав и использование
Природный и попутный газы, их состав и использование Молибден. Получение молибдена
Молибден. Получение молибдена Классификация спиртов. Изомерия спиртов
Классификация спиртов. Изомерия спиртов Алкены
Алкены Закалка без полиморфного превращения
Закалка без полиморфного превращения Подгруппа алюминия
Подгруппа алюминия Калийные удобрения
Калийные удобрения Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Свойства основных липопротеинов (ЛП) плазмы крови
Свойства основных липопротеинов (ЛП) плазмы крови Смеси: гетерогенные, гомогенные
Смеси: гетерогенные, гомогенные Типы химических реакций
Типы химических реакций Строение вещества
Строение вещества Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Реакции обмена
Реакции обмена