Содержание
- 2. Составьте уравнения полуреакций окисления и восстановления, определите окислитель и восстановитель в реакции: 1 вариант – взаимодействия
- 3. Методом электронного баланса расставьте коэффициенты в схеме реакции: 1 вариант – BaSO4 + C → BaS
- 4. ЧТО ОБЪЕДИНЯЕТ ? Нанесение металлических покрытий на различные поверхности
- 5. Как это происходит? Какой химический процесс лежит в основе? ЭЛЕКТРОЛИЗ
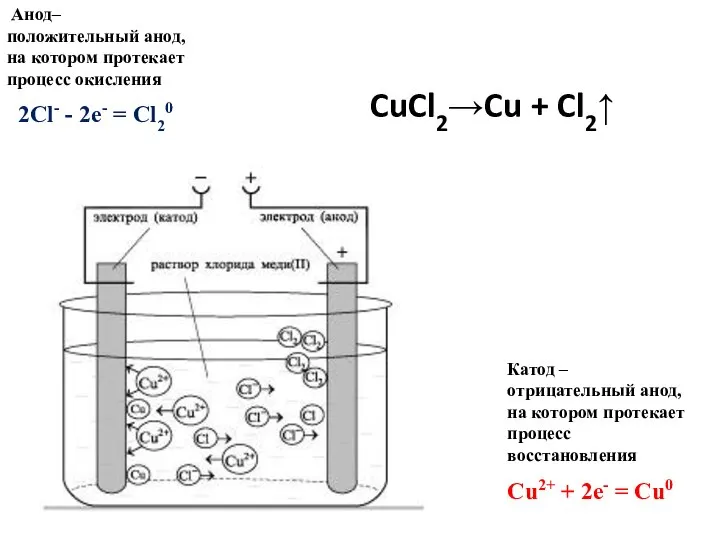
- 6. Катод – отрицательный анод, на котором протекает процесс восстановления Анод– положительный анод, на котором протекает процесс
- 11. Скачать презентацию






 Устойчивое развитие
Устойчивое развитие Основы химии буровых растворов
Основы химии буровых растворов Вода – самое удивительное вещество на Земле
Вода – самое удивительное вещество на Земле Полимеры
Полимеры Презентация на тему Кристаллическая решетка
Презентация на тему Кристаллическая решетка  Молекулярно-кинетическая теория. Макро- и микропараметры
Молекулярно-кинетическая теория. Макро- и микропараметры Сахароза (С12Н22О11)
Сахароза (С12Н22О11) Презентация на тему Войди в природу другом
Презентация на тему Войди в природу другом  Небезпечні речовини
Небезпечні речовини Строение электронных оболочек атомов элементов
Строение электронных оболочек атомов элементов Условия преобразования органических веществ
Условия преобразования органических веществ Изучаем химию с Агатой Кристи
Изучаем химию с Агатой Кристи Сера
Сера Химические свойства воды
Химические свойства воды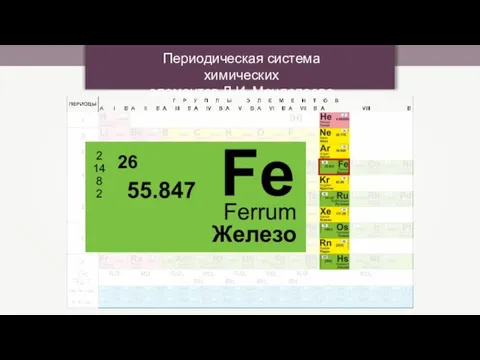 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Изомерия
Изомерия Эмульсии
Эмульсии Очистка рабочих электродов
Очистка рабочих электродов Ксантановая камедь
Ксантановая камедь Презентация на тему Химия в сельском хозяйстве
Презентация на тему Химия в сельском хозяйстве  Полимеры и пластмассы
Полимеры и пластмассы Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Алмазы
Алмазы Электролиз
Электролиз Периодический закон и периодическая система химических элементов. 11 класс
Периодический закон и периодическая система химических элементов. 11 класс Молекулярная струйная печать
Молекулярная струйная печать Презентация на тему Что такое нано?
Презентация на тему Что такое нано?  Пространственное строение органических соединений
Пространственное строение органических соединений