Содержание
- 2. Простейшие представители: CH4 Метан C2H6 Этан CnH2n+2, n ≥ 1 Общая формула Гомологи (др.-греч. ὅμοιος «подобный,
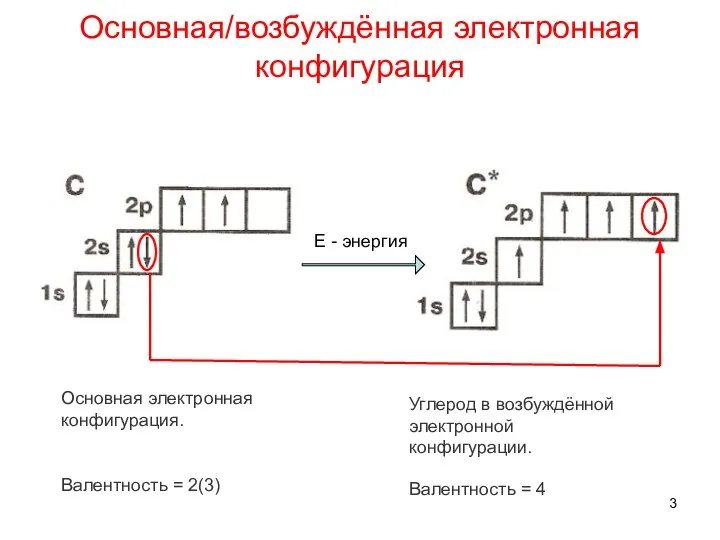
- 3. Основная/возбуждённая электронная конфигурация Основная электронная конфигурация. Валентность = 2(3) Углерод в возбуждённой электронной конфигурации. Е -
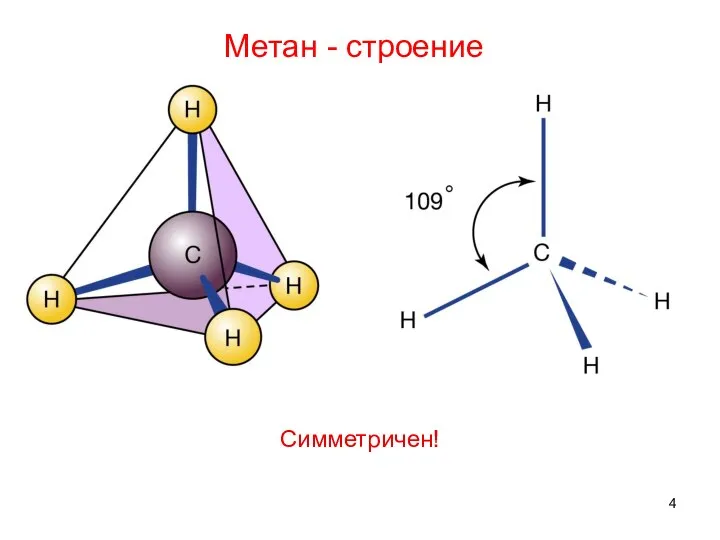
- 4. Метан - строение Симметричен!
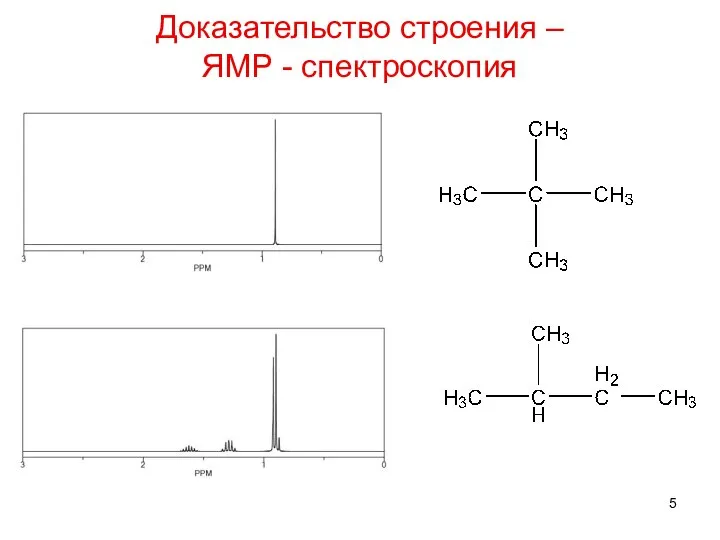
- 5. Доказательство строения – ЯМР - спектроскопия
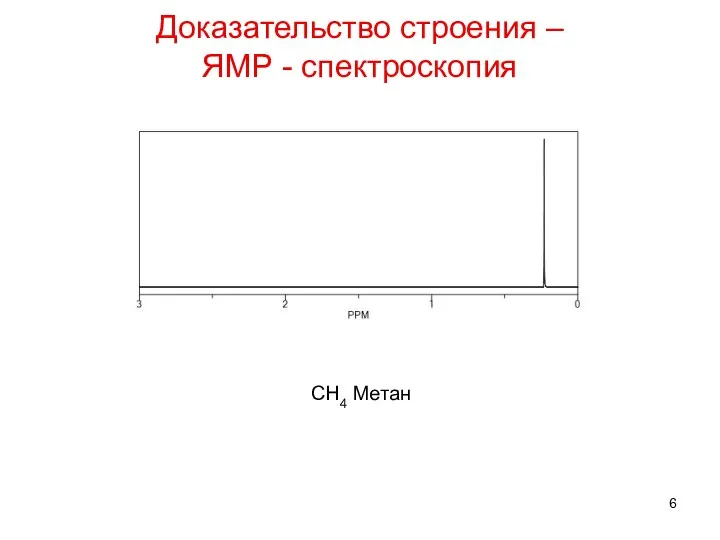
- 6. Доказательство строения – ЯМР - спектроскопия CH4 Метан
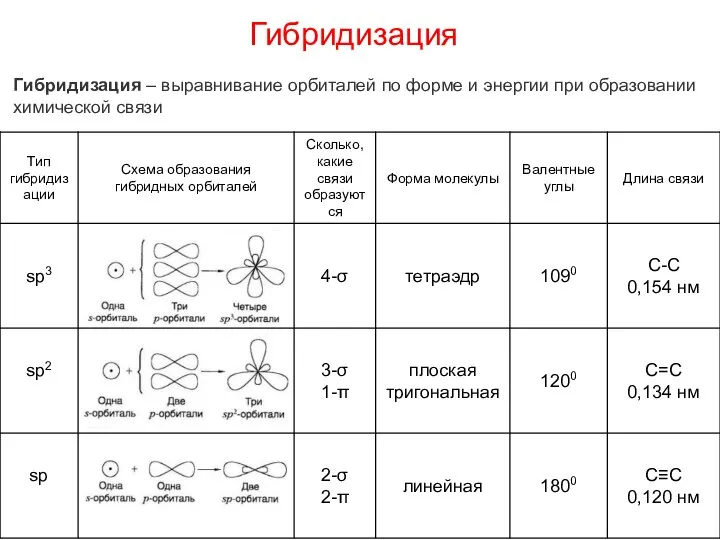
- 7. Гибридизация Гибридизация – выравнивание орбиталей по форме и энергии при образовании химической связи
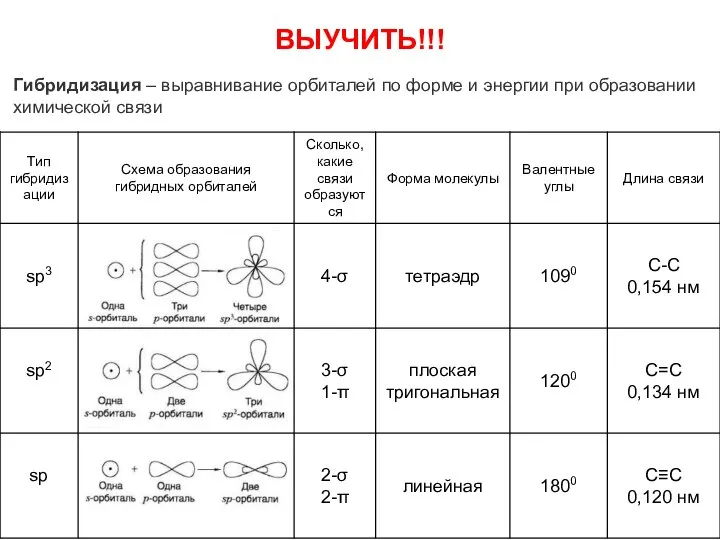
- 8. Гибридизация – выравнивание орбиталей по форме и энергии при образовании химической связи ВЫУЧИТЬ!!!
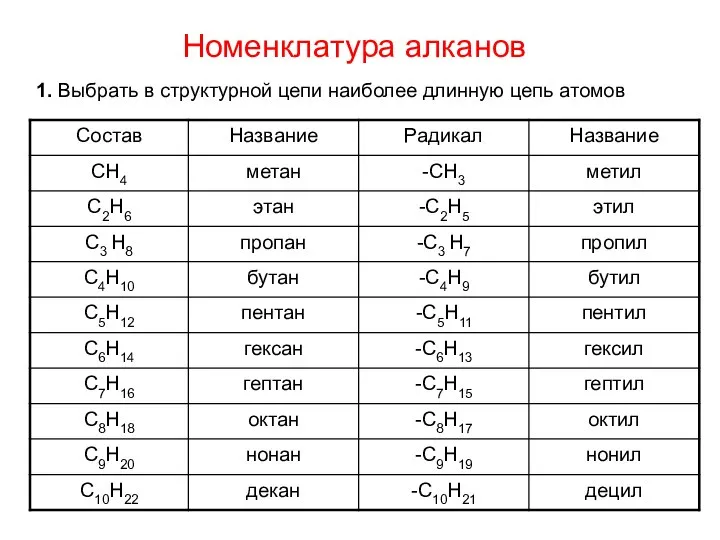
- 9. Номенклатура алканов 1. Выбрать в структурной цепи наиболее длинную цепь атомов
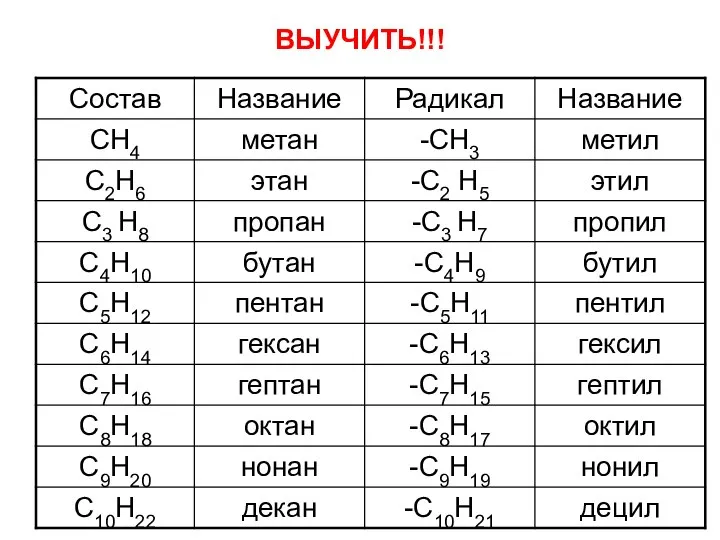
- 10. ВЫУЧИТЬ!!!
- 11. ВЫУЧИТЬ!!!
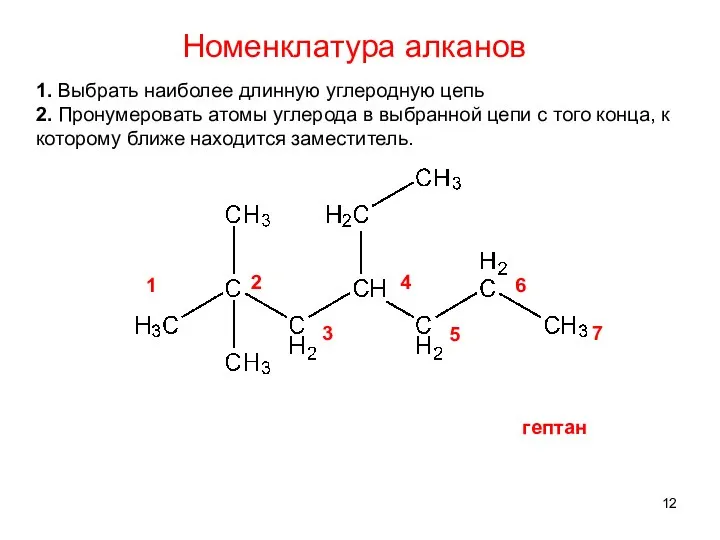
- 12. 1. Выбрать наиболее длинную углеродную цепь 2. Пронумеровать атомы углерода в выбранной цепи с того конца,
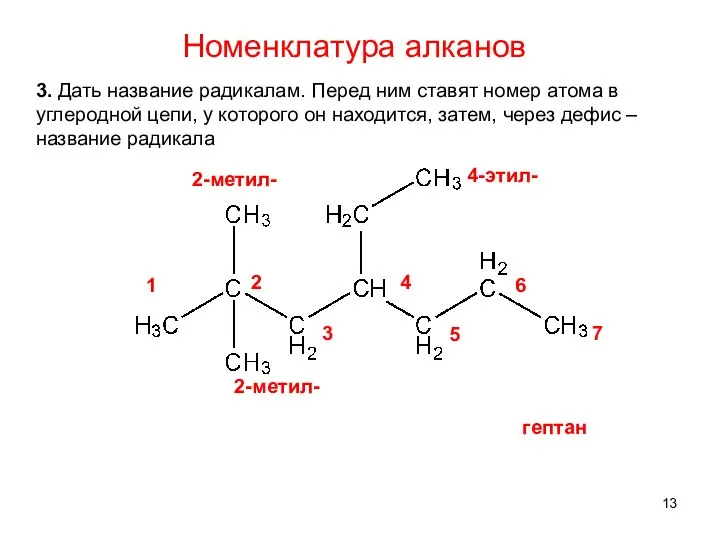
- 13. 3. Дать название радикалам. Перед ним ставят номер атома в углеродной цепи, у которого он находится,
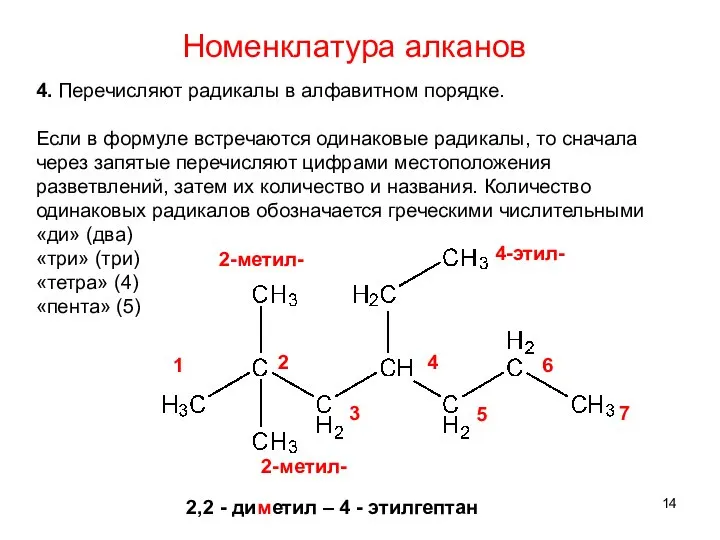
- 14. 4. Перечисляют радикалы в алфавитном порядке. Если в формуле встречаются одинаковые радикалы, то сначала через запятые
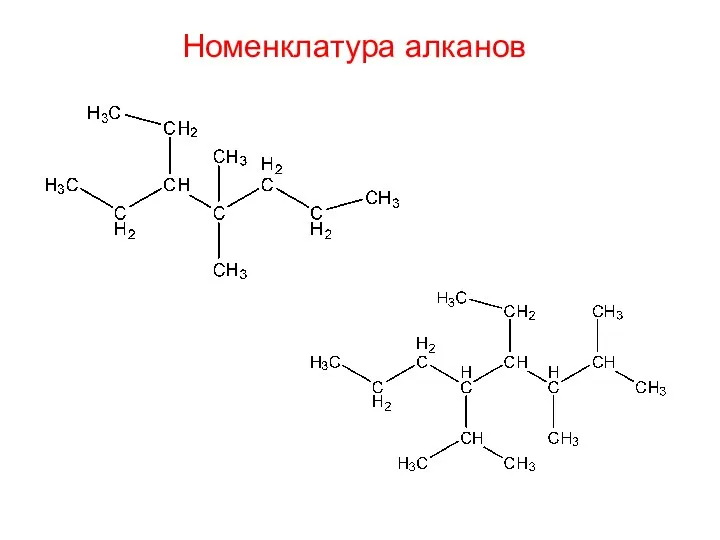
- 15. Номенклатура алканов
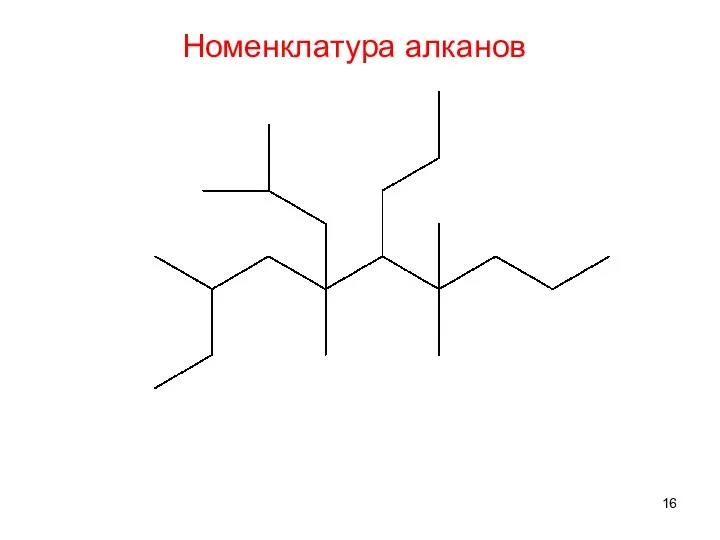
- 16. Номенклатура алканов
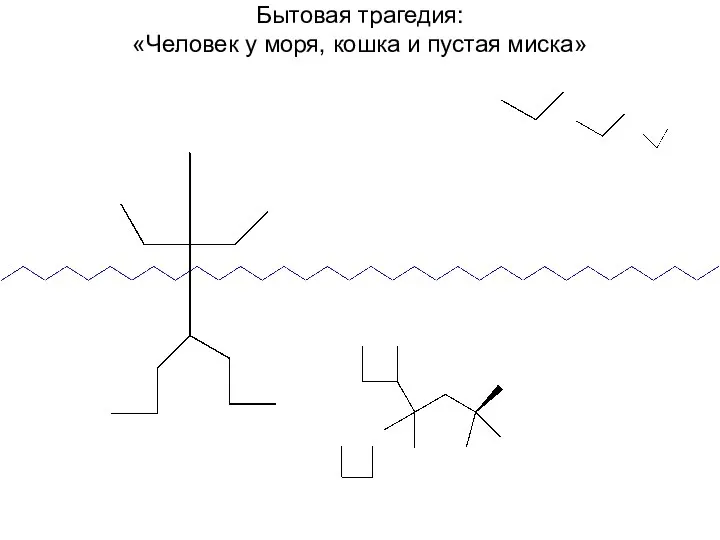
- 17. Бытовая трагедия: «Человек у моря, кошка и пустая миска»
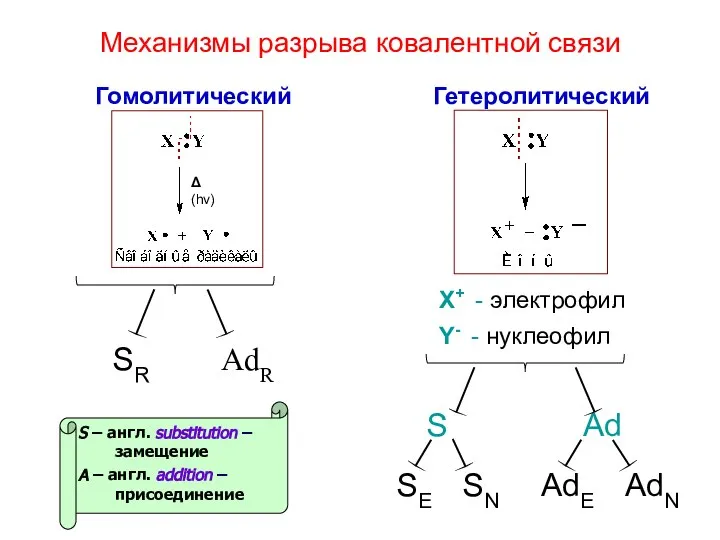
- 18. Механизмы разрыва ковалентной связи Гомолитический Гетеролитический Δ (hν) SR AdR AdE AdN SE SN S Ad
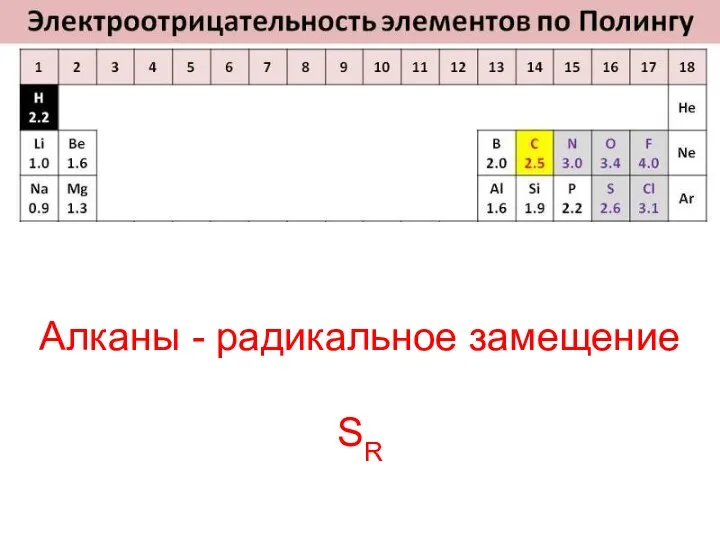
- 19. Алканы - радикальное замещение SR
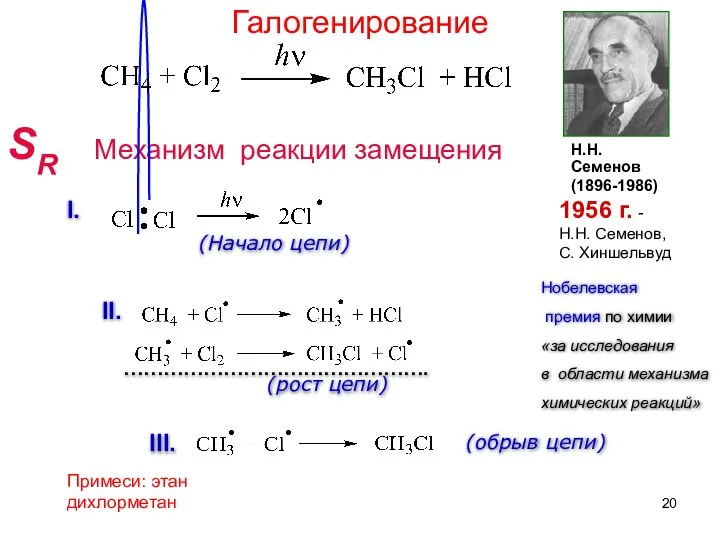
- 20. SR Механизм реакции замещения Н.Н. Семенов (1896-1986) 1956 г. - Н.Н. Семенов, С. Хиншельвуд Нобелевская премия
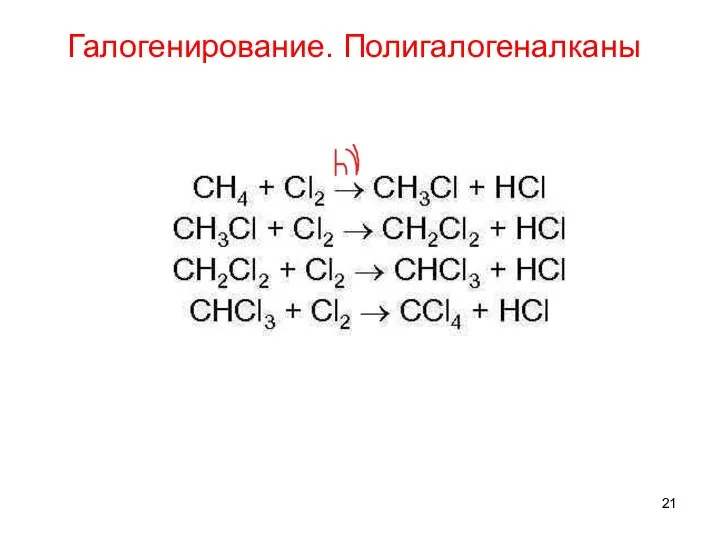
- 21. Галогенирование. Полигалогеналканы
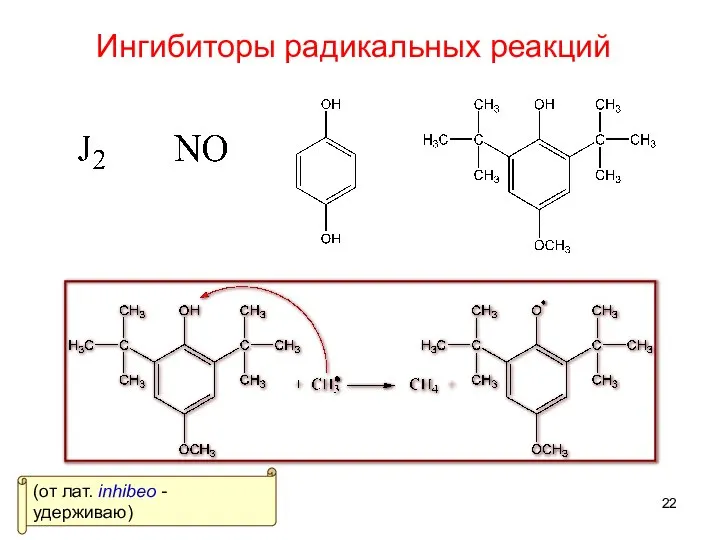
- 22. Ингибиторы радикальных реакций (от лат. inhibeo - удерживаю)
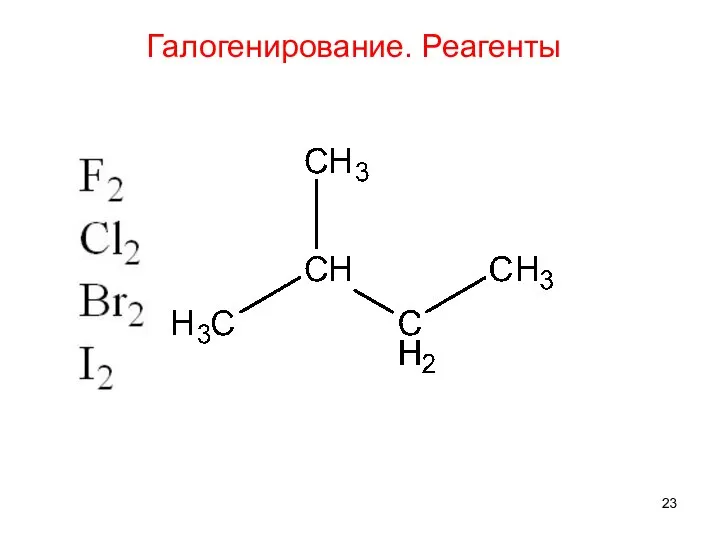
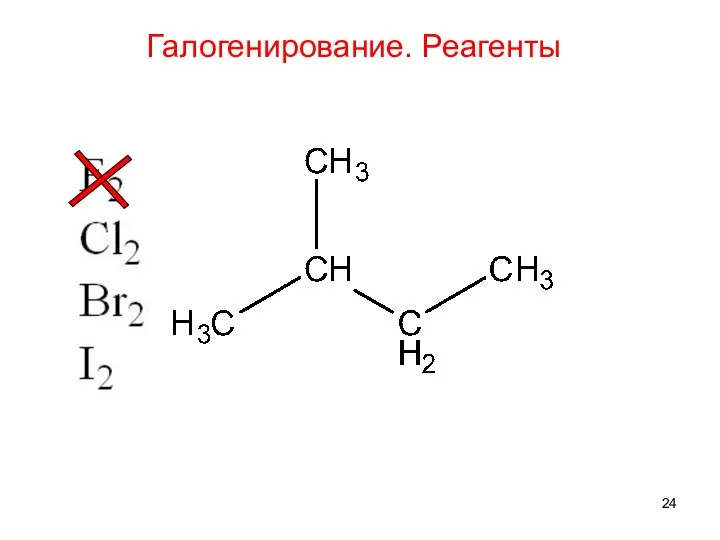
- 23. Галогенирование. Реагенты
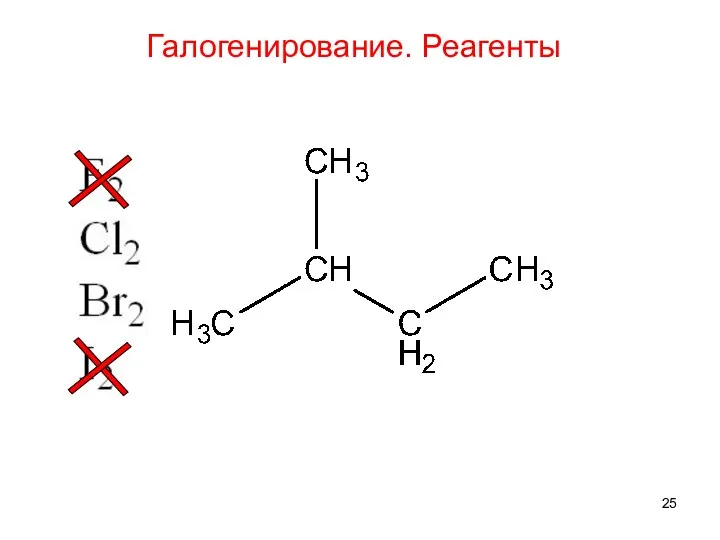
- 24. Галогенирование. Реагенты
- 25. Галогенирование. Реагенты
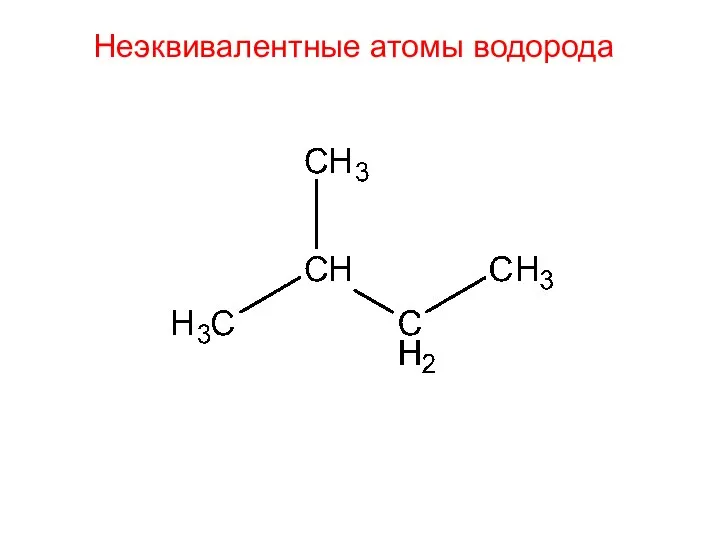
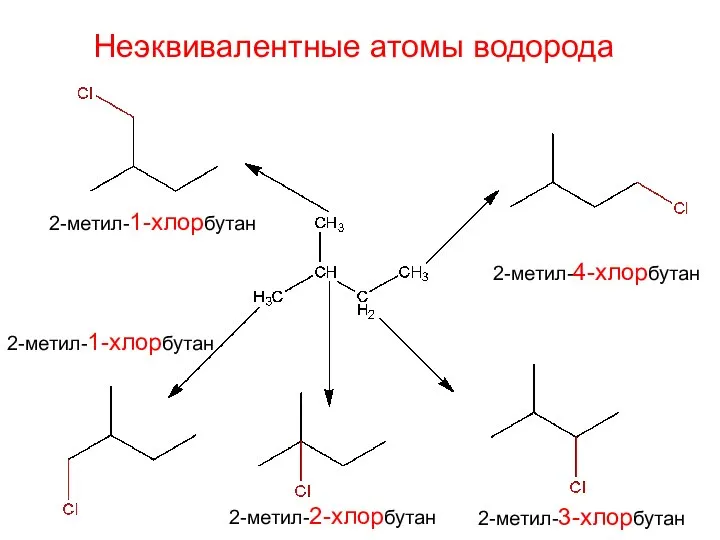
- 26. Неэквивалентные атомы водорода
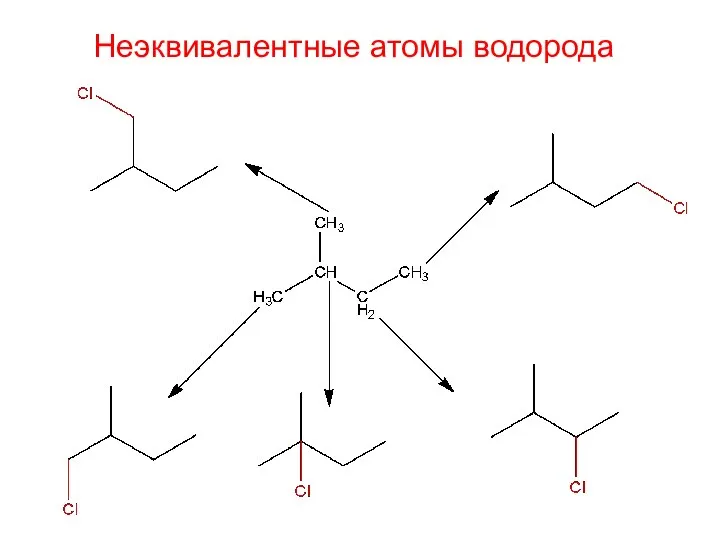
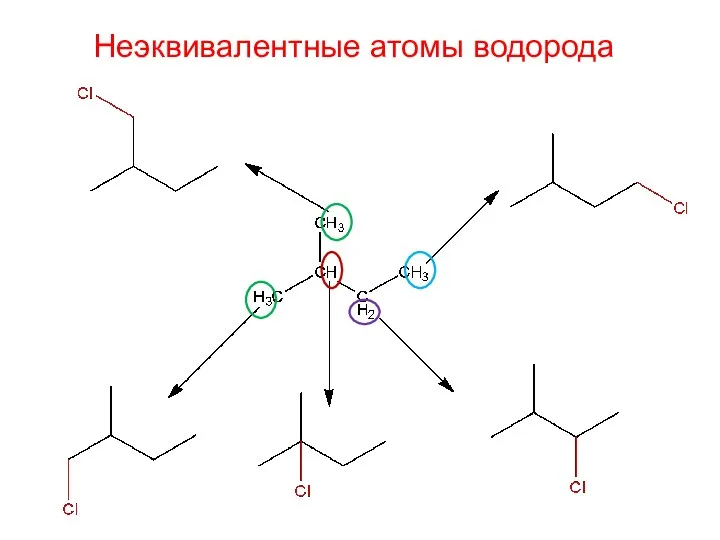
- 27. Неэквивалентные атомы водорода
- 28. Неэквивалентные атомы водорода 2-метил-1-хлорбутан 2-метил-1-хлорбутан 2-метил-2-хлорбутан 2-метил-3-хлорбутан 2-метил-4-хлорбутан
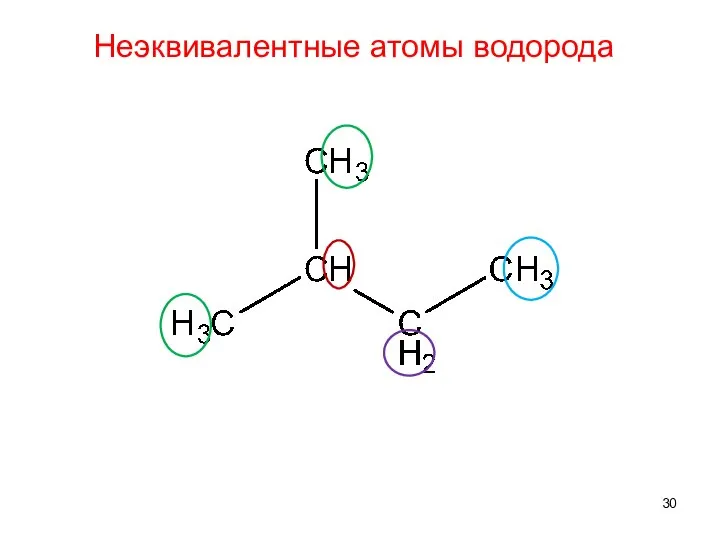
- 29. Неэквивалентные атомы водорода
- 30. Неэквивалентные атомы водорода
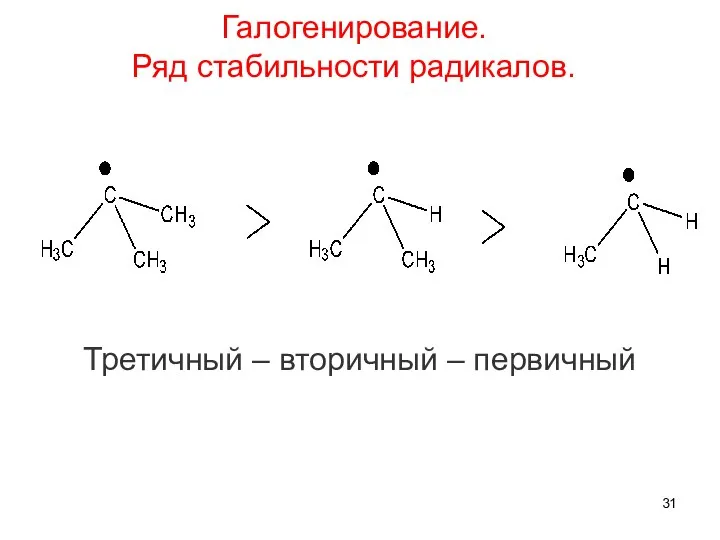
- 31. Третичный – вторичный – первичный Галогенирование. Ряд стабильности радикалов.
- 32. 2) Нитрование (реакция М.И. Коновалова) CH4 + HNO3(раствор) t˚С → CH3NO2 + H2O нитрометан 4) Реакции
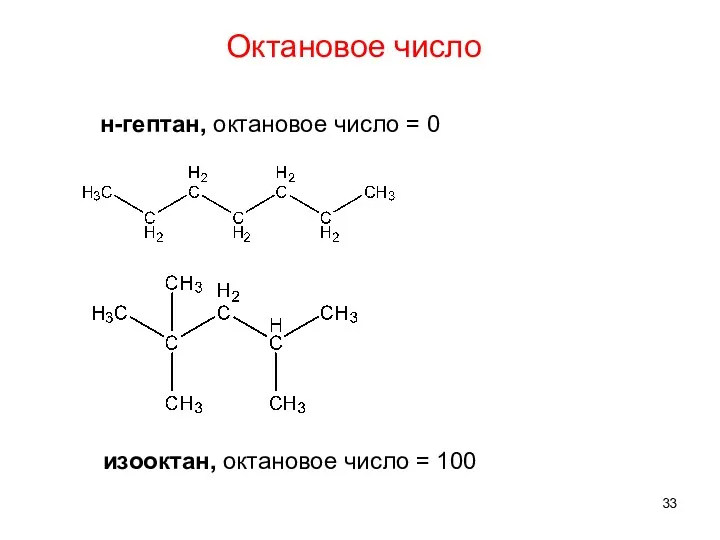
- 33. н-гептан, октановое число = 0 изооктан, октановое число = 100 Октановое число
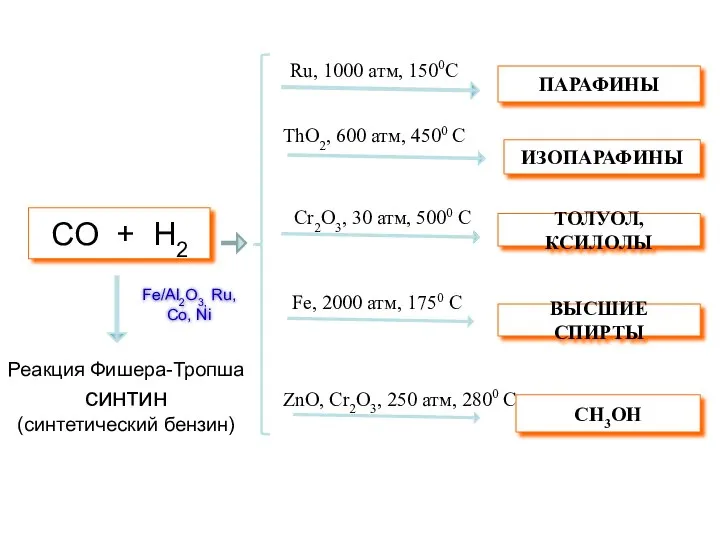
- 34. СO + H2 Ru, 1000 атм, 1500C ThO2, 600 атм, 4500 C Cr2O3, 30 атм, 5000
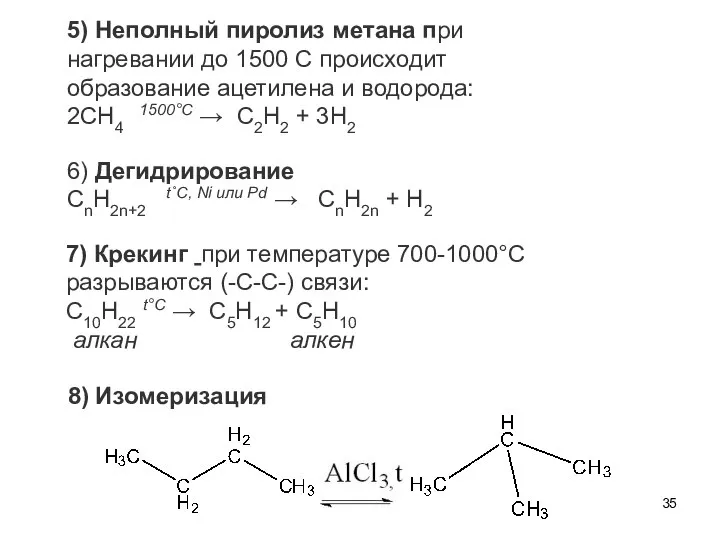
- 35. 5) Неполный пиролиз метана при нагревании до 1500 С происходит образование ацетилена и водорода: 2CH4 1500°С
- 36. ПОЛУЧЕНИЕ
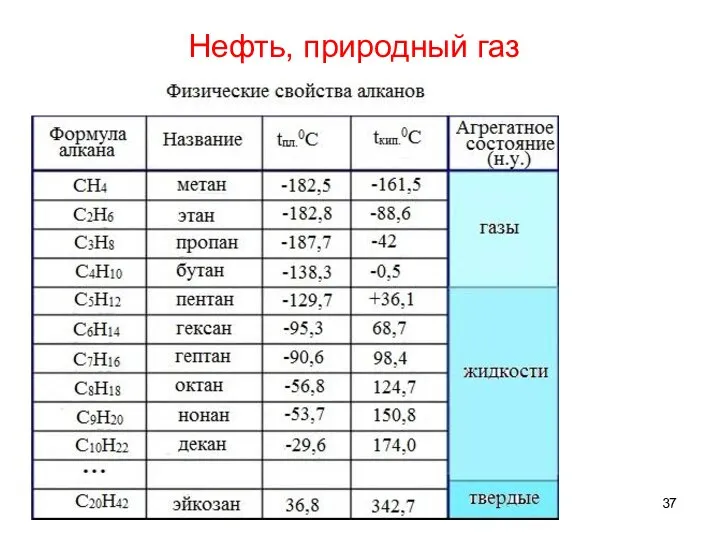
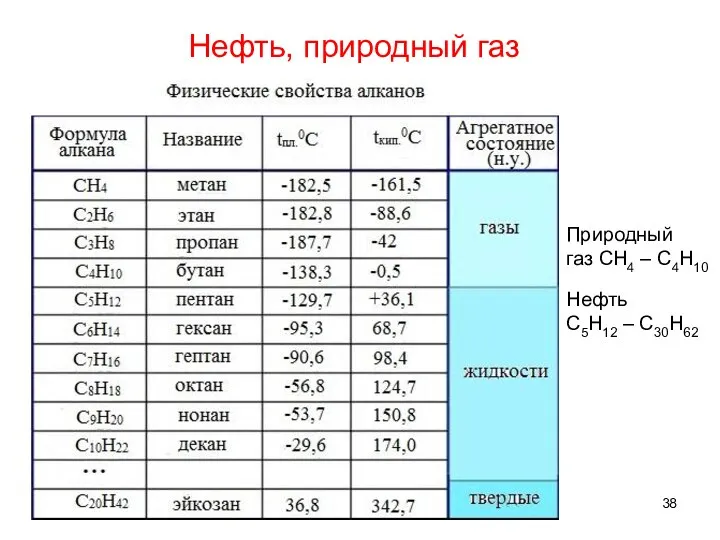
- 37. Нефть, природный газ
- 38. Нефть, природный газ Природный газ СH4 – C4H10 Нефть C5H12 – C30H62
- 40. Реакция Вюрца Реакция Вюрца может быть использована исключительно для синтеза симметричных алканов (R-R) с четным числом
- 41. Гидролиз карбидов 4Al + 3C = Al4C3 Al4C3 + 12H2O = 3CH4 + 4Al(OH)3
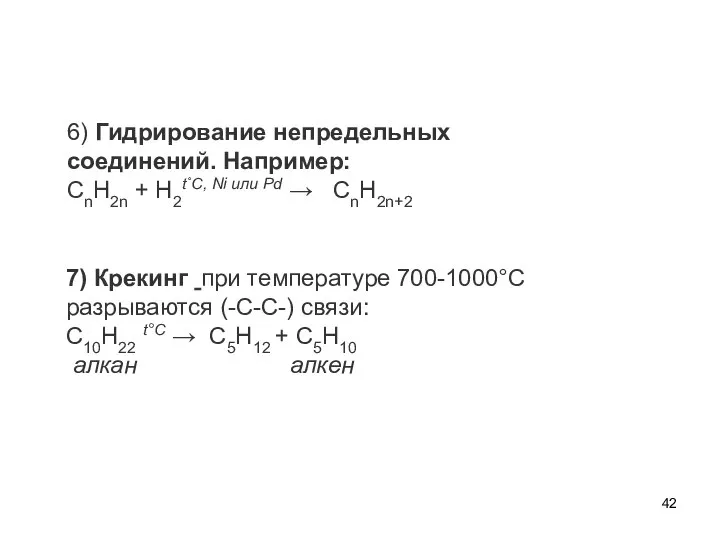
- 42. 6) Гидрирование непредельных соединений. Например: CnH2n + H2t˚С, Ni или Pd → CnH2n+2 7) Крекинг при
- 44. Скачать презентацию







 Основания, их состав и название
Основания, их состав и название Полимеры в медицине
Полимеры в медицине Общая характеристика галогенов. 9 класс
Общая характеристика галогенов. 9 класс Коррозия металлов
Коррозия металлов Канифоль. Физико-химические показатели
Канифоль. Физико-химические показатели Кислоты
Кислоты Аминокислоты и белки. Химия
Аминокислоты и белки. Химия Сульфиды (2)
Сульфиды (2) Управления реакций
Управления реакций Серная кислота
Серная кислота Кристаллы и минералы
Кристаллы и минералы Научные принципы химического производства
Научные принципы химического производства Биосинтез кортикостероидов из ацетил КоА и ХС
Биосинтез кортикостероидов из ацетил КоА и ХС Строение твердых и жидких металлов. Зональная ликвация
Строение твердых и жидких металлов. Зональная ликвация Аттестационная работа. Музей минералов и горных пород
Аттестационная работа. Музей минералов и горных пород Азотистые основания. Нуклеотиды и нуклеозиды. ДНК и РНК
Азотистые основания. Нуклеотиды и нуклеозиды. ДНК и РНК Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Призер муниципального єтапа всероссийской олимпиады школьников по химии Карасева Светлана
Призер муниципального єтапа всероссийской олимпиады школьников по химии Карасева Светлана Закон эквивалентов
Закон эквивалентов Получение аммиака и изучение его свойств. Практическая работа № 2
Получение аммиака и изучение его свойств. Практическая работа № 2 Осаждение нитрида кремния
Осаждение нитрида кремния Великий закон Дмитрия Ивановича Менделеева
Великий закон Дмитрия Ивановича Менделеева Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот Фосфор
Фосфор Основной закон радиоактивного распада и активность радионуклидов
Основной закон радиоактивного распада и активность радионуклидов Витамины. Способы получения
Витамины. Способы получения Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы Скорость химической реакции. Факторы, влияющие на скорость
Скорость химической реакции. Факторы, влияющие на скорость