Содержание
- 2. Реакции обмена в растворах электролитов Протекание реакций обмена в растворах электролитов обусловливается присутствующими в растворе ионами.
- 3. Гидролиз соли – обменное взаимодействие соли с водой, приводящее к образованию слабого электролита.
- 4. Гидролизу подвергаются растворимые соли, образованные: слабым основанием и сильной кислотой (гидролиз по катиону); сильным основанием и
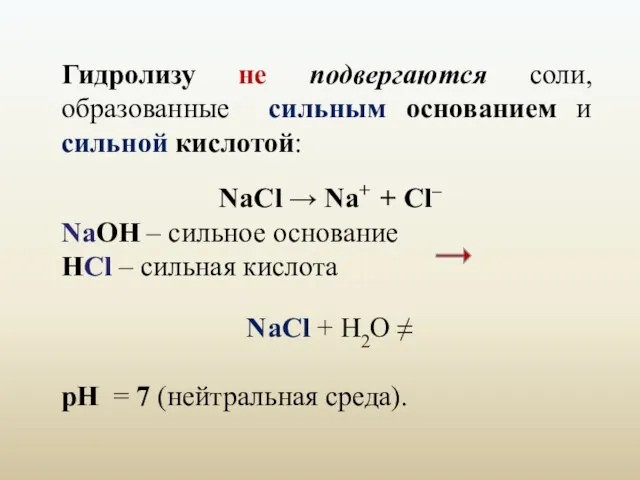
- 5. Гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой: NaCl → Na+ + Cl– NaОН
- 6. Правила гидролиза: 1. В гидролизе участвуют только катионы слабого основания или анионы слабой кислоты. 2. Гидролиз
- 7. Примеры: 1. Соль образована слабым основанием и сильной кислотой. NH4NO3 → NH4+ + NO3– NH4OH –
- 8. ZnCl2 → Zn2+ + 2Cl– Zn(ОН)2 – слабое основание НCl – сильная кислота гидролиз по катиону
- 9. 2. Соль образована сильным основанием и слабой кислотой. Ca(NO2)2 → Ca2+ + 2NO2– Ca(ОН)2 – сильное
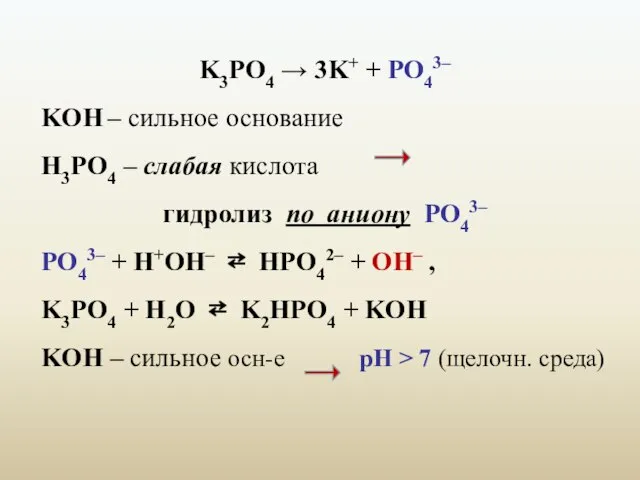
- 10. K3PO4 → 3K+ + PO43– KОН – сильное основание H3PO4 – слабая кислота гидролиз по аниону
- 11. !!! Процесс гидролиза много-зарядных ионов (для 1-го и 2-го случаев) протекает по первой ступени. Продуктами гидролиза
- 12. При гидролизе каких солей образуются основные и кислые соли? Основные соли образуются при ступенчатом гидролизе солей,
- 13. 3. Соль образована слабым основанием и слабой кислотой. NH4СN → NH4+ + CN– NH4OH – слабое
- 14. Ионно-молекулярные уравнения гидролиза ионов: NH4+ + Н+ОН– ⇄ NH4OH + H+ СN– + Н+ОН– ⇄ HСN
- 15. Чем больше Kд, тем сильнее электролит. Kд(NH4OH) =1,8·10–5 > Kд(HCN) = 6,2·10–10, то среда раствора соли
- 16. Al2S3 → 2Al3+ + 3S2– Al(ОН)3 – слабое основание H2S – слабая кислота гидролиз и по
- 17. !!! По первой ступени: сильное + слабая слабое + сильная По всем ступеням: слабое + слабая
- 18. Совместный гидролиз двух солей (необратимый гидролиз) При сливании водных растворов двух солей, имеющих разную природу, т.е.
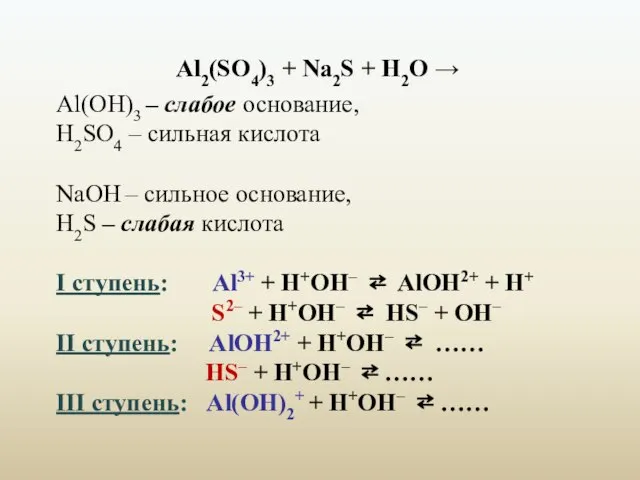
- 19. Al2(SO4)3 + Na2S + H2O → Al(ОН)3 – слабое основание, H2SO4 – сильная кислота NaОН –
- 20. Суммарное ионно-молекулярное уравнение: 2Al3+ + 3S2– + 6H2O = 2Al(OH)3 ↓ + 3H2S ↑ Молекулярное уравнение:
- 21. Количественные характеристики гидролиза: константа гидролиза KГ; cтепень гидролиза h.
- 22. Константа гидролиза KГ – константа равновесия процесса гидролиза, харак-теризует глубину его протекания. KГ зависит от: природы
- 23. Константа гидролиза равна отношению ионного произведения воды к константе диссоциации слабого электролита с номером ступени, численно
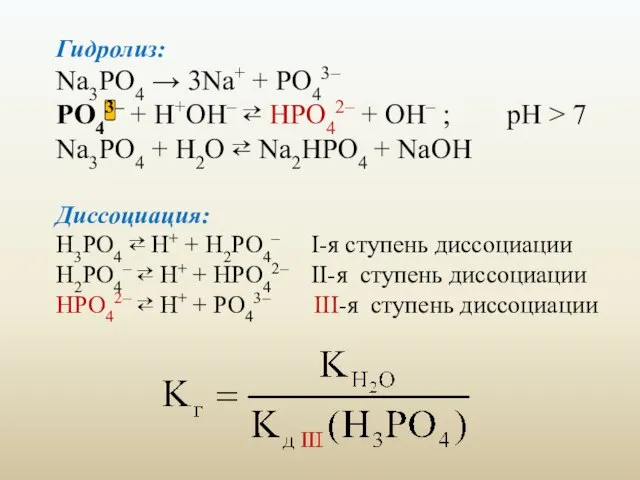
- 24. Гидролиз: Na3PO4 → 3Na+ + PO43– PO43– + H+OH– ⇄ HPO42– + OH– ; pH >
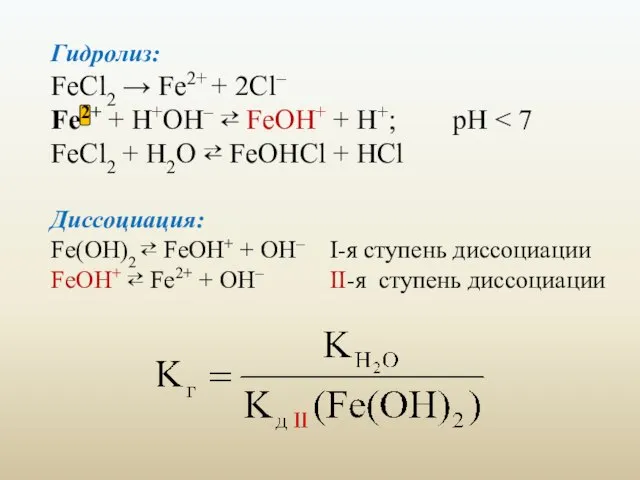
- 25. Гидролиз: FeCl2 → Fe2+ + 2Cl– Fe2+ + H+OH– ⇄ FeOH+ + H+; pH FeCl2 +
- 26. !!! При расчете константы гидролиза нужно брать KД слабого электролита по последней ступени диссоциации.
- 27. Степень гидролиза (h) – отношение количества прогидролизовавшейся соли (Сгидр) к общему количеству соли в растворе (Со):
- 28. Степень и константа гидролиза связаны соотношением: или
- 29. Концентрация ионов Н+ и ОН– в растворе соли: Расчет рН:
- 30. Пример: Вычислите pH 0,2 н. раствора Na2СO3. Алгоритм решения задач на рН соли 1. Записать ур-ние
- 31. Факторы, влияющие на глубину протекания гидролиза Глубина протекания гидролиза зависит от следующих факторов: 1. Природа соли
- 32. 2. Температура. Гидролиз является эндотермическим процессом, поэтому с повышением температуры константа гидролиза увеличивается, в соответствии с
- 33. 4. Наличие одноименных или разно-именных ионов (введение в раствор ионов H+ или OH–). Введение ионов, одноименных
- 34. → Для усиления процесса гидролиза следует: повысить температуру; разбавить раствор; ввести разноименные ионы: если соль гидролизуется
- 35. ← Для подавления процесса гидролиза следует: охладить раствор; увеличить концентрацию соли в растворе; ввести одноименные ионы:
- 37. Скачать презентацию





























 Неорганическая и органическая химия
Неорганическая и органическая химия Химические явления
Химические явления Строение и физические свойства металлов
Строение и физические свойства металлов Презентация на тему Электрохимический ряд напряжений металлов
Презентация на тему Электрохимический ряд напряжений металлов  Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Общая характеристика металлов
Общая характеристика металлов Prezentatsia_lektsia_Reaktora_2_Materialny_balans
Prezentatsia_lektsia_Reaktora_2_Materialny_balans Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс) Ионная связь
Ионная связь Образовательные технологии, используемые на уроках химии для повышения мотивации обучения
Образовательные технологии, используемые на уроках химии для повышения мотивации обучения Что такое электрон?
Что такое электрон? Практическая работа 1. ХТП. Классификация химических реакций
Практическая работа 1. ХТП. Классификация химических реакций Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Презентация на тему Привычная и удивительная поваренная соль
Презентация на тему Привычная и удивительная поваренная соль  Презентация1
Презентация1 Будова електронних оболонок і властивості хіиічних елементів. (8 клас)
Будова електронних оболонок і властивості хіиічних елементів. (8 клас) Спирты и их производные
Спирты и их производные Турнир смекалистых. Все о кислотах
Турнир смекалистых. Все о кислотах Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Теория химического строения А. М. Бутлерова
Теория химического строения А. М. Бутлерова Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Классификация загрязняющих веществ по фазово-дисперсному составу
Классификация загрязняющих веществ по фазово-дисперсному составу ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Свойства воды
Свойства воды Массообменные процессы
Массообменные процессы Солевые кристаллы
Солевые кристаллы Оксиды. Физические свойства
Оксиды. Физические свойства Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота