Содержание
- 2. Оксид фосфора (V). Фосфорная кислота и ее соли
- 3. Белый, рыхлый гигроскопичный порошок. Оксид фосфора(V) P2O5 образуется при горении фосфора на воздухе: 4Р + 5О2
- 4. Химические свойства оксида фосфора (V): P2O5 – типичный кислотный оксид. 1) При взаимодействии с водой образует
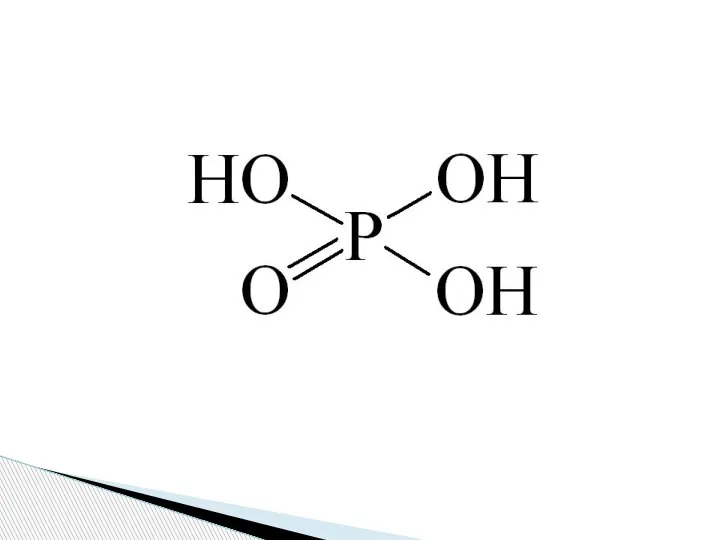
- 5. H3PO4 - бесцветное твердое кристаллическое вещество. Температура плавления +42ºС, хорошо растворяется в воде. Фосфорная кислота -
- 7. Химические свойства H3PO4 Фосфорная кислота вступает во многие реакции, характерные для кислот: 1). С металлами, стоящими
- 8. Фосфорную кислоту используют: в производстве фосфорных удобрений; в производстве кормовых добавок для животноводства; в производстве моющих
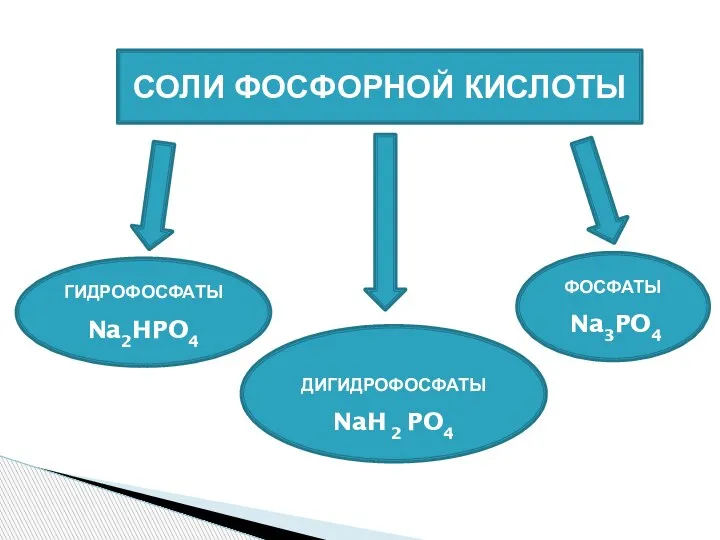
- 9. СОЛИ ФОСФОРНОЙ КИСЛОТЫ ГИДРОФОСФАТЫ Na2HPO4 ДИГИДРОФОСФАТЫ NaH 2 PO4 ФОСФАТЫ Na3PO4
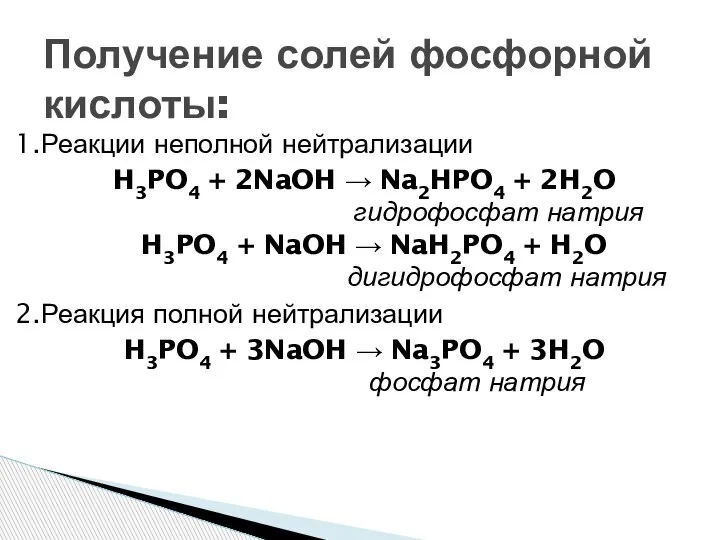
- 10. Получение солей фосфорной кислоты: 1.Реакции неполной нейтрализации H3PO4 + 2NaOH → Na2HPO4 + 2H2O гидрофосфат натрия
- 11. Соли фосфорной кислоты – кристаллические вещества. Средние соли, или фосфаты (например, Са3(РО4)2), нерастворимы в воде, кроме
- 12. Фосфат кальция Фосфат калия Фосфат аммония Фосфат серебра
- 14. Скачать презентацию








 Непредельные углеводороды
Непредельные углеводороды Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Соли и их свойства
Соли и их свойства Оксиды
Оксиды Подготовка к итоговой контрольной работе
Подготовка к итоговой контрольной работе Электролитическая диссоциация уксусной и муравьиной кислоты
Электролитическая диссоциация уксусной и муравьиной кислоты Строение атома
Строение атома Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Презентация на тему Окислительно восстановительные реакции сущность
Презентация на тему Окислительно восстановительные реакции сущность  Творческий отчет кружка Юные химики
Творческий отчет кружка Юные химики Надмолекулярные структуры
Надмолекулярные структуры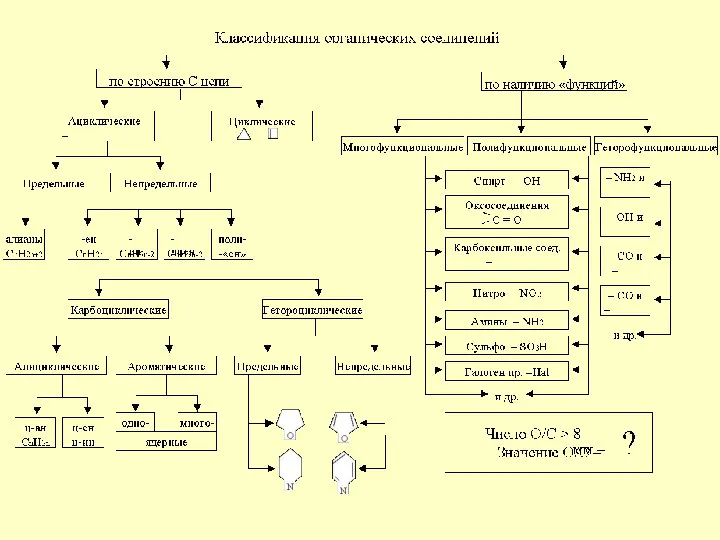 Классификация органических соединений
Классификация органических соединений Материаловедение. Методы исследования в материаловедении (лекция 1)
Материаловедение. Методы исследования в материаловедении (лекция 1) Классификация реагентов и реакций в органической химии. (Лекция 4)
Классификация реагентов и реакций в органической химии. (Лекция 4) Pастворы, используемые в промышленности
Pастворы, используемые в промышленности Как химия может помочь вам в быту?
Как химия может помочь вам в быту? Алканы: гомологический ряд, строение, номенклатура, физические свойства
Алканы: гомологический ряд, строение, номенклатура, физические свойства Углерод
Углерод Сера и её соединения
Сера и её соединения Классификация органических соединений
Классификация органических соединений Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина)
Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина) Химические реакции
Химические реакции Сельскохозяйственная токсикология
Сельскохозяйственная токсикология Презентация на тему Электролитическая диссоциация
Презентация на тему Электролитическая диссоциация  Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, ОВР
Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, ОВР Материаловедение для пирсера. Материалы, используемые в пирсинге
Материаловедение для пирсера. Материалы, используемые в пирсинге Презентация на тему Выбирай вопрос и отвечай
Презентация на тему Выбирай вопрос и отвечай