> Вторичный R+ >> Третичный R+
Относительная скорость 30 1 0,03 0
Низкая реакционная способность третичных галогенидов объясняется пространственными препятствиями, создаваемыми алкильными группами при
α−углероде, для атаки нуклеофилом с тыльной стороны.
2. Природа уходящей группы. Аналогично SN1
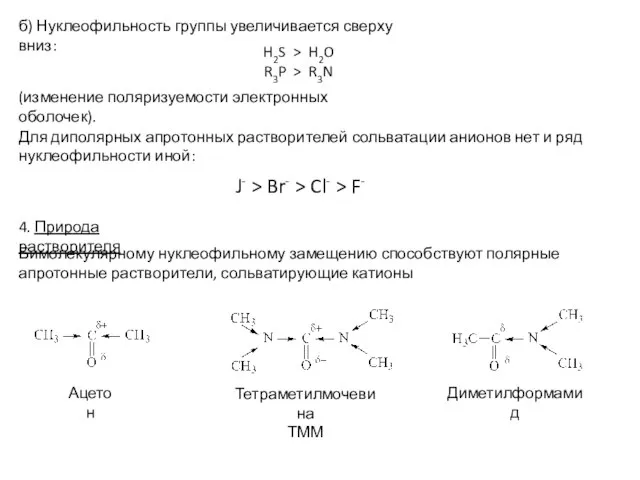
J- > Br- > Cl- > F-
3. Природа нуклеофильного реагента
Анионы значительно более сильные нуклеофилы, чем сопряженные им кислоты
Для протонных растворителей:
а) Нуклеофильность реагентов в одном периоде совпадает с рядом основности, т.е. убывает слева направо в периоде
NH2- > OH- > F-
NH3 > H2O




 Химическая география чудес
Химическая география чудес Основы молекулярно-кинетической теории
Основы молекулярно-кинетической теории Коррозия металлов и сплавов
Коррозия металлов и сплавов ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Ситалл – искусственный поликристаллический материал
Ситалл – искусственный поликристаллический материал Классы неорганических соединений
Классы неорганических соединений Арены. Бензол
Арены. Бензол Алифатические соединения. Тема № 6
Алифатические соединения. Тема № 6 АРЕНЫ
АРЕНЫ Аэрозоли и аэродисперсии
Аэрозоли и аэродисперсии Спирты
Спирты Свойство металлов и сплавов
Свойство металлов и сплавов Кислоты, основания и соли как электролиты
Кислоты, основания и соли как электролиты 5кл 20.10практична робота
5кл 20.10практична робота Криогенный разрыв пласта
Криогенный разрыв пласта Хим_10_30_Производство_аммиака
Хим_10_30_Производство_аммиака Гигиена воздуха
Гигиена воздуха Судың диссоциациясы
Судың диссоциациясы Презентация по Химии "Строении атомов. Химическая связь"
Презентация по Химии "Строении атомов. Химическая связь"  Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Азот
Азот Косметические средства и бытовая химия
Косметические средства и бытовая химия Металлы
Металлы Алкадиены. Строение. Изомерия. Свойства
Алкадиены. Строение. Изомерия. Свойства Великие русские химики
Великие русские химики Химическая связь
Химическая связь Химия крови. Состав и функции крови
Химия крови. Состав и функции крови