Слайд 2Гидролиз солей.
Гидролиз – это реакция обменного разложения веществ водой.

Слайд 3Гидролиз органических веществ.
1. Гидролиз галогеналканов.
С2Н5Сl + Н2О →С2Н5ОН + НСl
2. Гидролиз
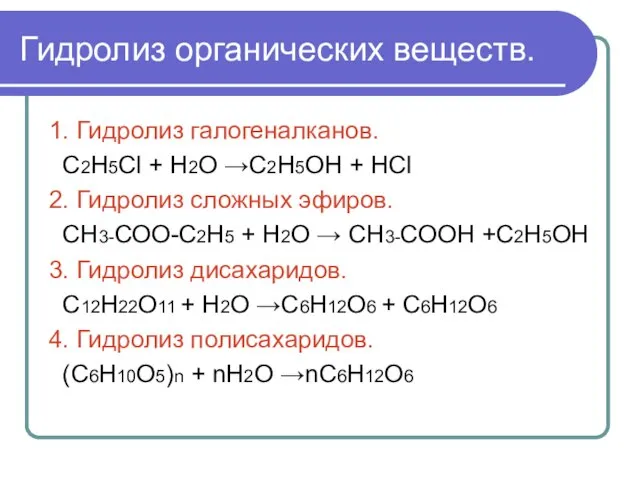
сложных эфиров.
СН3-СОО-С2Н5 + Н2О → СН3-СООН +С2Н5ОН
3. Гидролиз дисахаридов.
С12Н22О11 + Н2О →С6Н12О6 + С6Н12О6
4. Гидролиз полисахаридов.
(С6Н10О5)n + nН2О →nС6Н12О6
Слайд 4Гидролиз неорганических веществ.
Гидролизу подвергаются растворы солей. Следовательно, водные растворы солей имеют разные

значения рН и различные типы сред:
Кислотную (рН<7).
Щелочную (рН>7).
Нейтральную (рН=7).
Слайд 5Классификация солей.
Любую соль можно представить как продукт взаимодействия основания с кислотой.
В зависимости

от силы основания и кислоты можно выделить 4 типа солей:
1. Соли, образованные сильным основанием и слабой кислотой (КСN, NaCH3COO).
2. Соли, образованные сильной кислотой и слабым основанием (СuCl2, FeSO4, Mn(NO3)2.
Слайд 6Классификация солей.
3. Соли, образованные слабой кислотой и
слабым основанием
(NH4CN, Cu(CH3COO)2).
4.

Соли, образованные сильной кислотой и сильным основанием
(NaCl, K2SO4, BaI2).
Слайд 7Соли, образованные сильным основанием и слабой кислотой.
NaCN + Н2О ↔ NaOH

+ HCN
NaCN ↔Na+ + CN‾
Н2О ↔ OH ‾ + H+
Полное ионное уравнение гидролиза:
Na+ + CN¯ + Н2О ↔ Na+ + OH¯ + HCN
Сокращённое уравнение гидролиза:
CN¯ + Н2О ↔ OH¯ + HCN
рн >7, среда щелочная, гидролиз по аниону.
Слайд 8Соли, образованные сильным основанием и слабой кислотой.
Гидролиз по аниону:
Обратимый процесс.
Химическое равновесие смещено

влево.
Реакция среды - щелочная, рН>7.
При гидролизе солей, образованных слабыми многоосновными кислотами образуются кислые соли.
Слайд 9Соли, образованные сильной кислотой и слабым основанием.
NH4Cl + H2O ↔ NH3·H2О +

НСl
NH4Cl ↔ NH4+ + Cl¯
Н2О ↔ OH¯ + H+
Полное ионное уравнение гидролиза:
NH4+ + Cl¯ + Н2О ↔ NH3 · H2О + H+ + Cl¯
Сокращённое уравнение гидролиза:
NH4+ + Н2О ↔ NH3 · H2О + H+
рн <7, среда кислотная, гидролиз по
катиону.
Слайд 10Соли, образованные сильной кислотой и слабым основанием.
Гидролиз по катиону:
Обратимый процесс.
Химическое равновесие смещено

влево.
Среда кислотная, рН<7.
Слайд 11Соли, образованные слабой кислотой и слабым основанием.
NH4СН3СОО + H2O ↔ СН3СООН

+ NH3 · H2О
NH4СН3СОО ↔ NH4 + + СН3СОО¯
Н2О ↔ OH¯ + H +
Ионное уравнение гидролиза:
NH4 + + СН3СОО¯ + Н2О ↔ NH3 · H2О + СН3СООН
рн = 7, среда нейтральная, гидролиз по
катиону и по аниону.
Слайд 12Соли, образованные слабой кислотой и слабым основанием.
Гидролиз по катиону и по аниону.
Химическое

равновесие смещено вправо.
Реакция среды или нейтральная, или слабокислая, или слабощелочная, что зависит от констант диссоциации кислоты и основания.
Гидролиз может быть необратимым, если хотя бы один из продуктов реакции гидролиза уходит из сферы реакции.
Слайд 13
Соли, образованные сильной кислотой и сильным основанием.
КСl + H2O ↔

КСl ↔ К + + Сl¯
Н2О ↔ OH¯ + H +
Все ионы остаются в растворе – гидролиз не происходит. Среда нейтральная, рН =7, т.к.
концентрации катионов водорода и гидроксид - анионов в растворе равны, как в чистой воде.
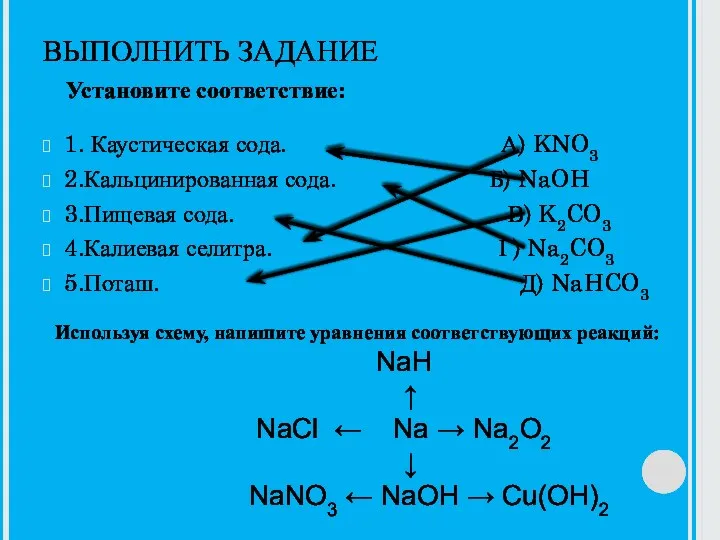
Слайд 14Гидролиз солей.
Гидролиз можно усилить:
Добавить воды.
Нагреть раствор (увеличится диссоциация воды).
Связать один из продуктов

гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу.













 Каустическая сода
Каустическая сода Сера и её соединения
Сера и её соединения Три службы Менделеева для России
Три службы Менделеева для России Разработка реактора для отопления домов путем извлечения водорода из воды
Разработка реактора для отопления домов путем извлечения водорода из воды Основы химического анализа. Лекция 8
Основы химического анализа. Лекция 8 Оксид цинка ZnO
Оксид цинка ZnO Презентация на тему Руды металлов
Презентация на тему Руды металлов  Степени окисления и формулы веществ
Степени окисления и формулы веществ Кислоты
Кислоты Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Соляная кислота
Соляная кислота Составление формул солей
Составление формул солей Презентация на тему Природные источники углеводородов (9 класс)
Презентация на тему Природные источники углеводородов (9 класс)  Многоэлектронные атомы
Многоэлектронные атомы Домашняя работа на каникулы
Домашняя работа на каникулы Презентация на тему Типы реакций
Презентация на тему Типы реакций  Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Облик и габитус кристаллов
Облик и габитус кристаллов Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Химия в быту
Химия в быту Диффузия и осмос
Диффузия и осмос Электронное и пространственное строение алкенов. Гомология и изомерия алкенов
Электронное и пространственное строение алкенов. Гомология и изомерия алкенов Карбоновые кислоты. Альдегиды
Карбоновые кислоты. Альдегиды Основные понятия химии
Основные понятия химии Галогены
Галогены Степень окисления
Степень окисления История гипса
История гипса Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи