Содержание
- 2. Периодический закон Д.И.Менделеева Свойства химических элементов и их соединений находятся в периодической зависимости от заряда их
- 3. Периодическая система химических элементов — это графическое отображение периодического закона. По горизонтали Периодическая система делится на
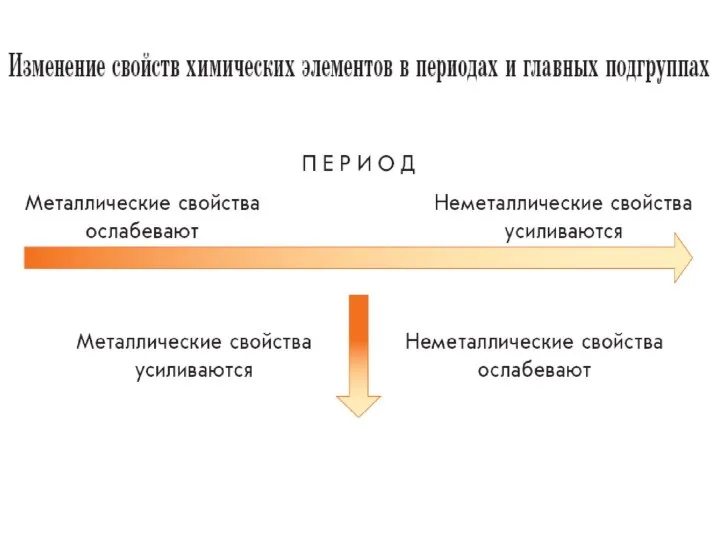
- 4. Периодом называют горизонтальный ряд химических элементов в таблице Менделеева, расположенных в порядке возрастания зарядов их атомных
- 5. Всего в Периодической системе семь периодов. Малым называют период, состоящий только из одного ряда. Большими называют
- 6. Группой называют вертикальный ряд химических элементов в таблице Менделеева, расположенных в порядке возрастания зарядов их атомных
- 7. Главной называют подгруппу, состоящую из элементов и малых, и больших периодов. Побочной называют подгруппу, состоящую только
- 9. Строение атома
- 10. Первой моделью атома, отражающей его сложное строение, была предложенная в 1904 г. модель Дж. Томсона, получившая
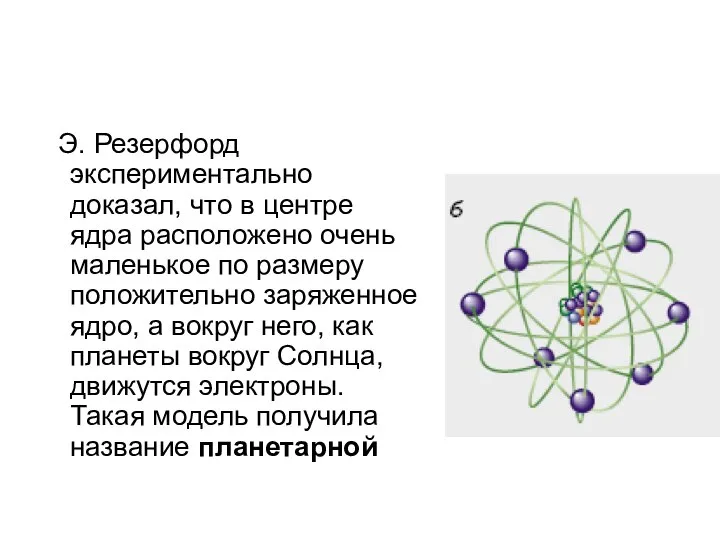
- 11. Э. Резерфорд экспериментально доказал, что в центре ядра расположено очень маленькое по размеру положительно заряженное ядро,
- 12. В 1896 г. французский физик А. Беккерель открыл радиоактивность — самопроизвольный распад атомов некоторых элементов,названных радиоактивными.
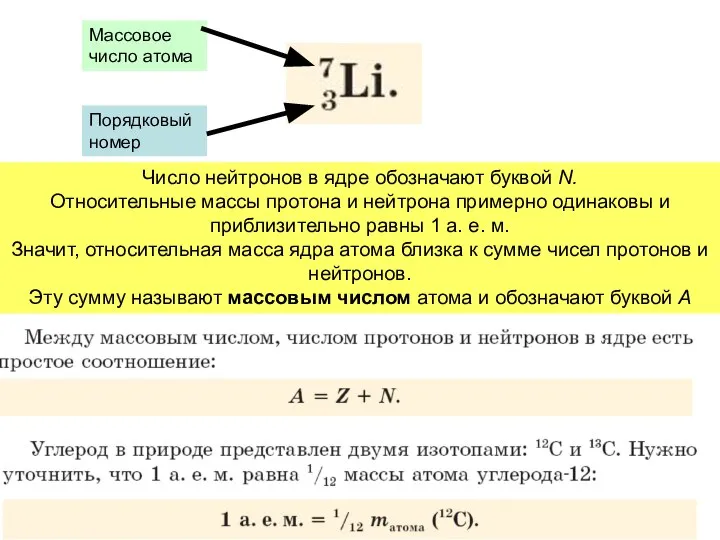
- 14. Число нейтронов в ядре обозначают буквой N. Относительные массы протона и нейтрона примерно одинаковы и приблизительно
- 16. Атомы одного и того же элемента, содержащие в ядрах разное число нейтронов и, следовательно, обладающие различными
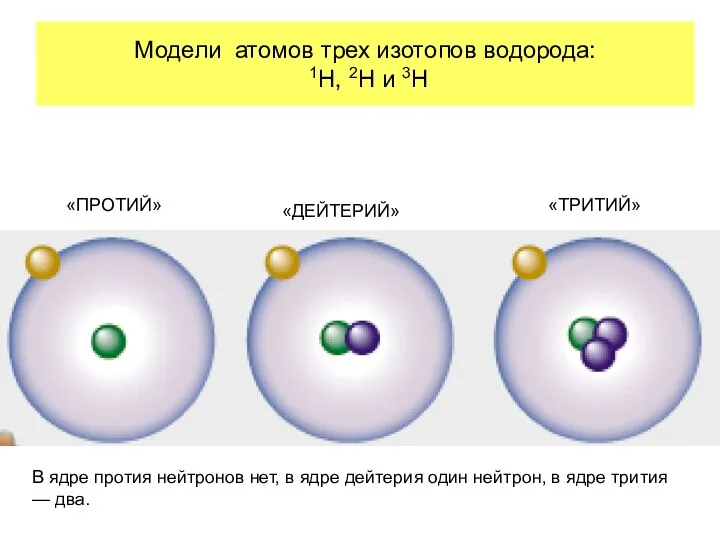
- 17. Модели атомов трех изотопов водорода: 1H, 2H и 3H «ПРОТИЙ» «ДЕЙТЕРИЙ» «ТРИТИЙ» В ядре протия нейтронов
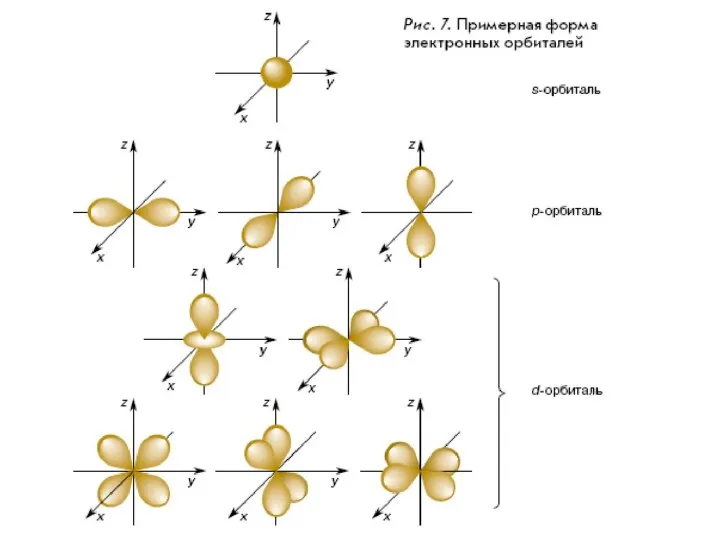
- 18. Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называют орбиталью s-Орбиталь имеет сферическую форму.
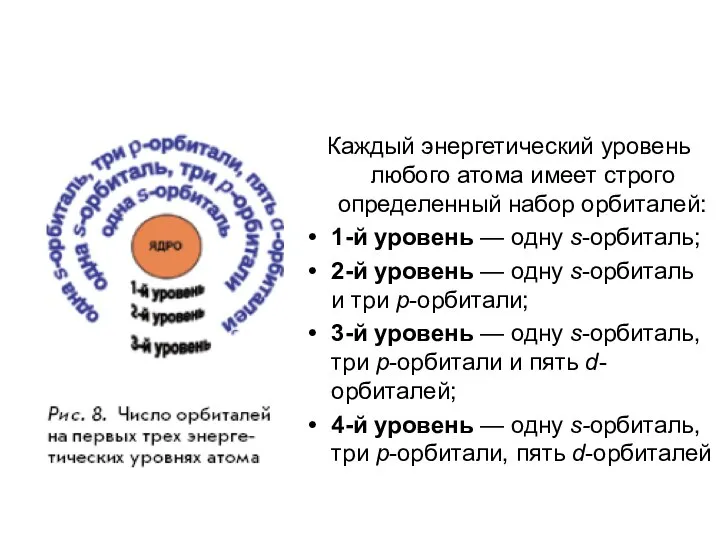
- 20. Каждый энергетический уровень любого атома имеет строго определенный набор орбиталей: 1-й уровень — одну s-орбиталь; 2-й
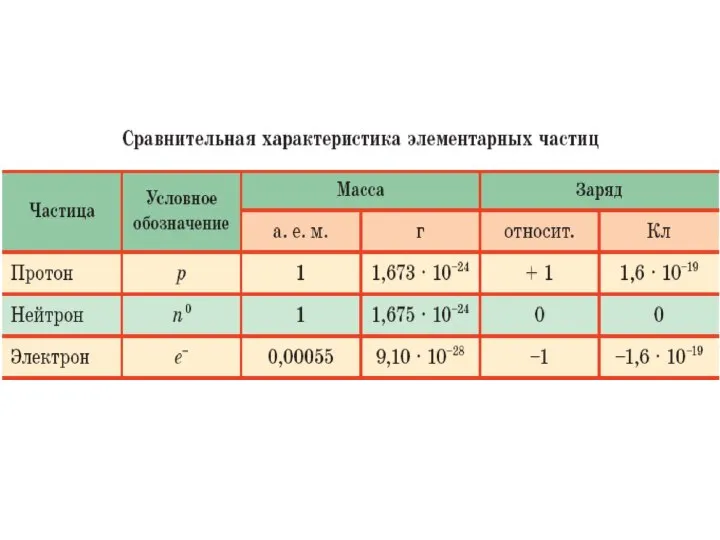
- 21. Атом состоит из ядра и электронной оболочки. Ядро содержит протоны и нейтроны. Вся масса атома сосредоточена
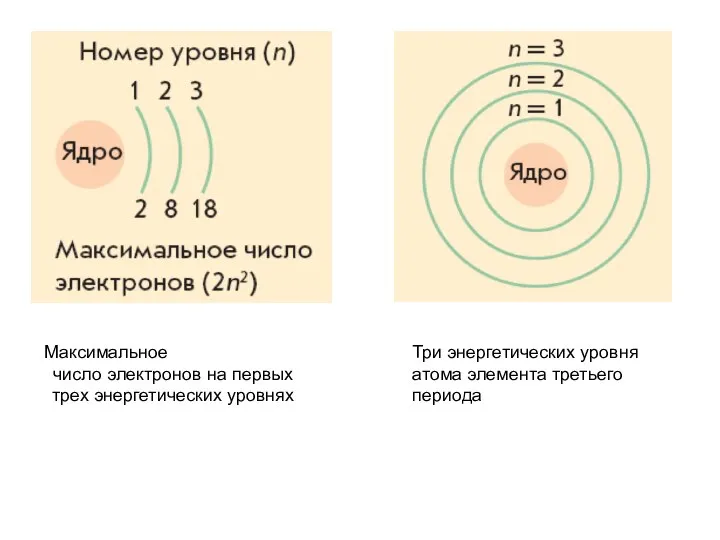
- 22. Электроны в ней располагаются по энергетическим уровням (слоям). Число уровней равно номеру периода, к которому принадлежит
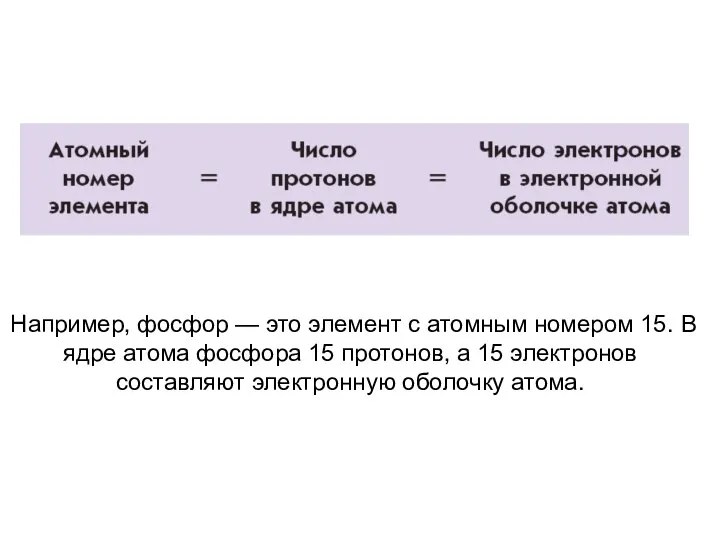
- 23. Например, фосфор — это элемент с атомным номером 15. В ядре атома фосфора 15 протонов, а
- 24. Три энергетических уровня атома элемента третьего периода Максимальное число электронов на первых трех энергетических уровнях
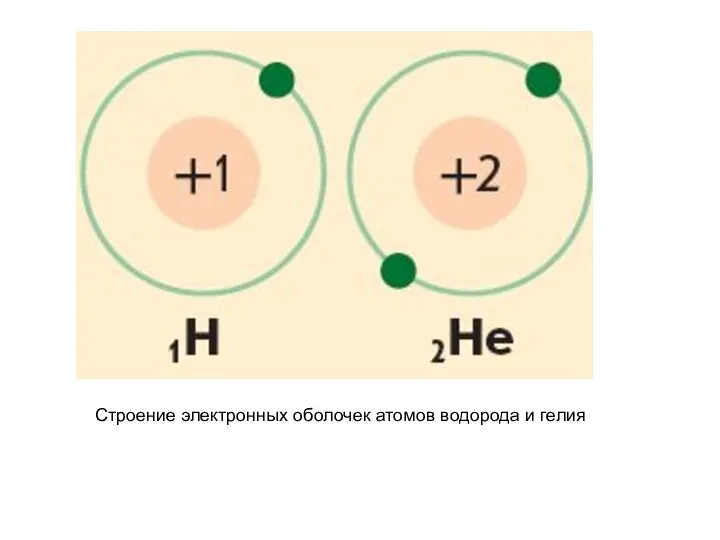
- 25. Строение электронных оболочек атомов водорода и гелия
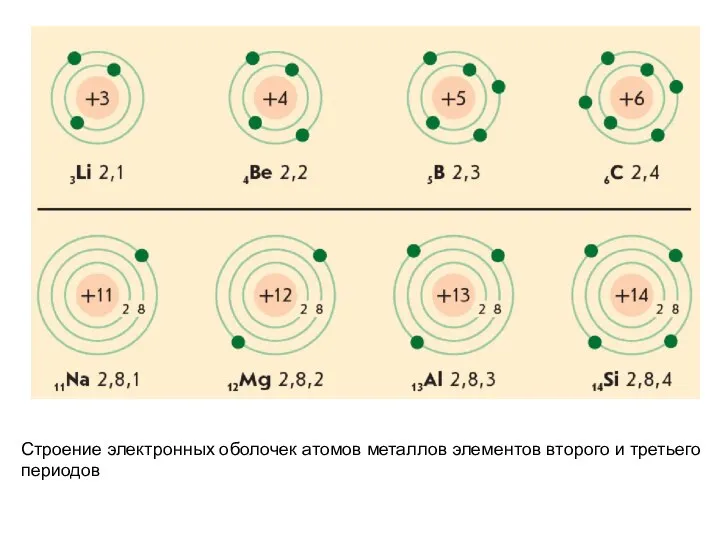
- 26. Строение электронных оболочек атомов металлов элементов второго и третьего периодов
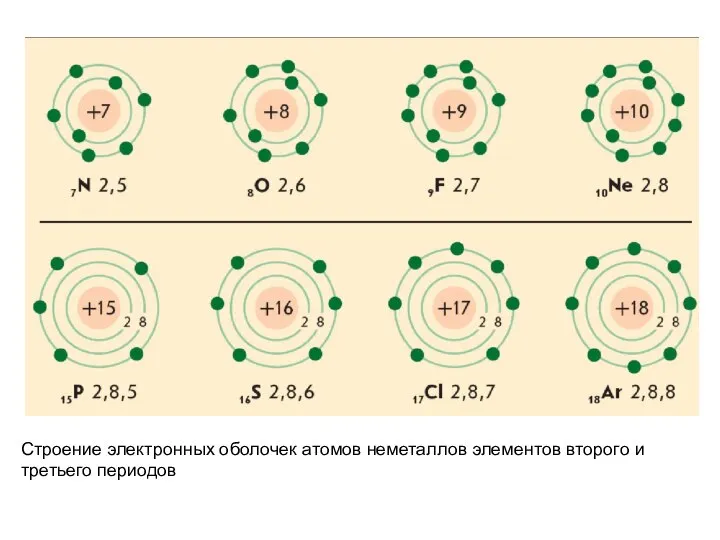
- 27. Строение электронных оболочек атомов неметаллов элементов второго и третьего периодов
- 28. Строение атома и периодический закон 1. Атомный (порядковый) номер химического элемента указывает на положительный заряд атомного
- 30. Скачать презентацию















 Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Практическое пособие по твердофазной экстракции
Практическое пособие по твердофазной экстракции Осторожно, химия
Осторожно, химия Растворы электролитов
Растворы электролитов Vzácne plyny
Vzácne plyny Исследование физико-химических свойств щавелевой кислоты
Исследование физико-химических свойств щавелевой кислоты Ионные уравнения
Ионные уравнения Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка
Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка Презентация на тему Неорганические и органические основания
Презентация на тему Неорганические и органические основания  Презентация на тему Алканолы
Презентация на тему Алканолы  Химические свойства кислот
Химические свойства кислот Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Силикатная промышленность
Силикатная промышленность Алканы хим. св-ва (1)
Алканы хим. св-ва (1) Кремний и его соединения
Кремний и его соединения Вещества в окружающей природе и в технике
Вещества в окружающей природе и в технике Реакционная способность химических соединений. Лекция 9
Реакционная способность химических соединений. Лекция 9 хим связь
хим связь Юные химики. Своя игра
Юные химики. Своя игра Substancje chemiczne
Substancje chemiczne Искусственные и синтетические ткани
Искусственные и синтетические ткани Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения
Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения Презентация на тему Витамин Е
Презентация на тему Витамин Е  علاوي الندوة
علاوي الندوة Химическая связь
Химическая связь Презентация на тему Полимеры. Каучуки. Резина
Презентация на тему Полимеры. Каучуки. Резина  Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание