Содержание
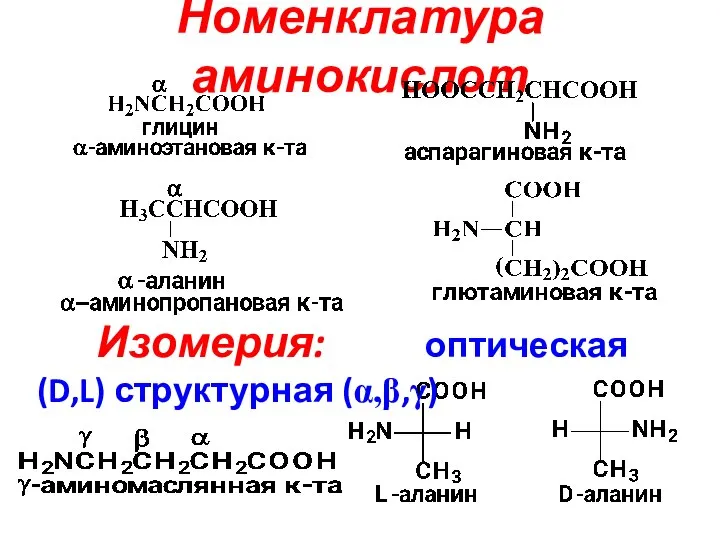
- 2. Номенклатура аминокислот Изомерия: оптическая (D,L) структурная (α,β,γ)
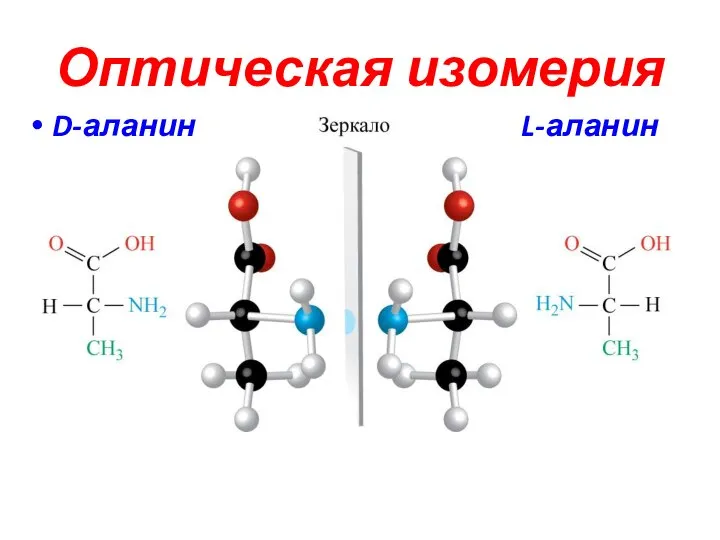
- 3. Оптическая изомерия D-аланин L-аланин
- 4. Способы получения 1. Гидролиз белков (для α-аминокислот)- Н+,ОН- ферментативный. Разделяют аминокислоты: ионообменной хром-ей, электрофорезом, ГЖХ. 2.
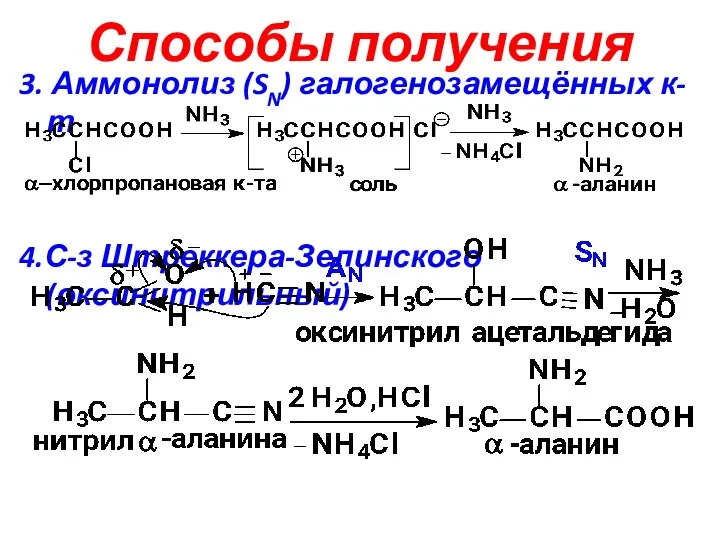
- 5. Способы получения 3. Аммонолиз (SN) галогенозамещённых к-т 4.С-з Штреккера-Зелинского(оксинитрильный)
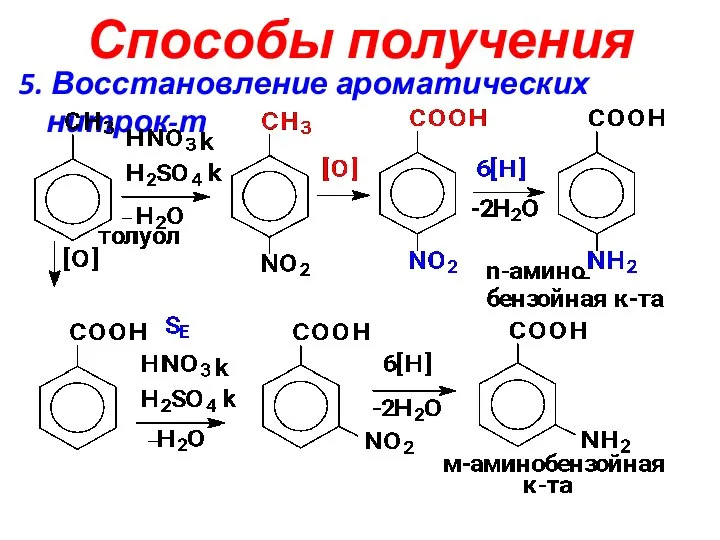
- 6. Способы получения 5. Восстановление ароматических нитрок-т
- 7. Физические св-ва α-аминок-т α-Аминокислоты–бесцветные крист. в-ва, ЛР в H2O, высокая tпл, нелетучи. Природные α-аминокислоты L-ряда –
- 8. Глутамат натрия E621 мононатриевая соль глутаминовой кислоты
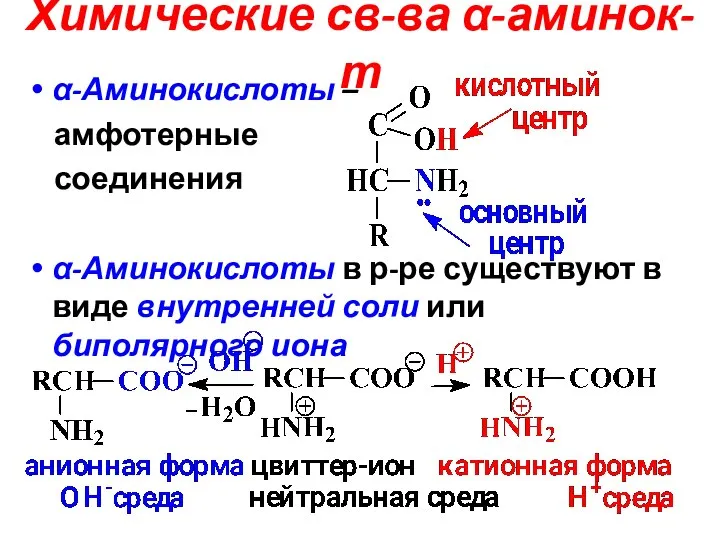
- 9. Химические св-ва α-аминок-т α-Аминокислоты – амфотерные соединения α-Аминокислоты в р-ре существуют в виде внутренней соли или
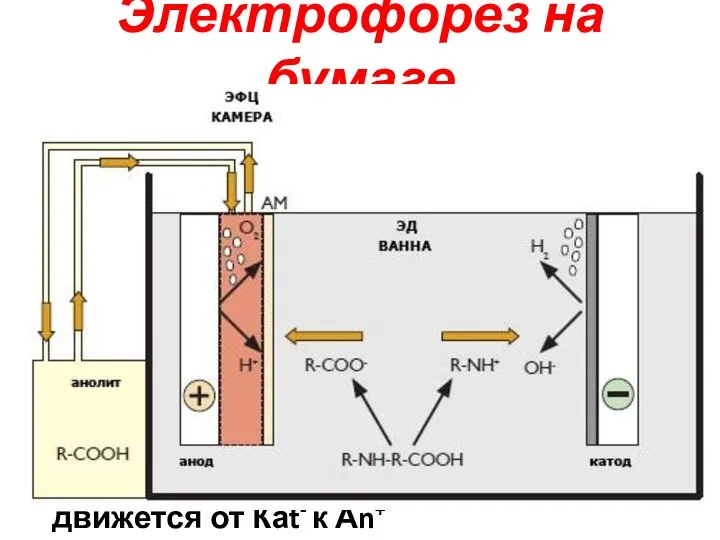
- 10. Ацетатный буферный р-р – аминокислота в катионной форме движется от Аn+ к Каt- Аммиачный буферный р-р
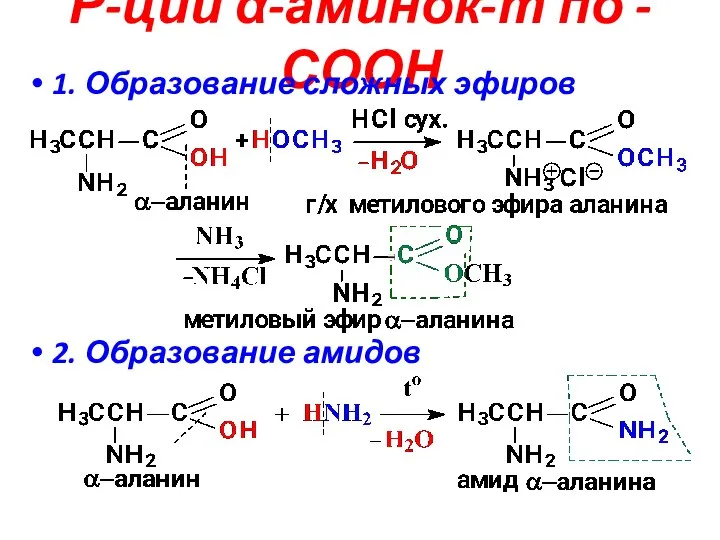
- 11. Р-ции α-аминок-т по -СООН 1. Образование сложных эфиров 2. Образование амидов
- 12. Р-ции α-аминок-т по -СООН 3. Образование галогенангидридов Ангидридов и галогенангидридов аминокислот не существует из-за высокой реакционоспособ-ти
- 13. Р-ции α-аминок-т по -NH2 1. Ацилирование (как способ защиты –NH2) 2. Алкилирование
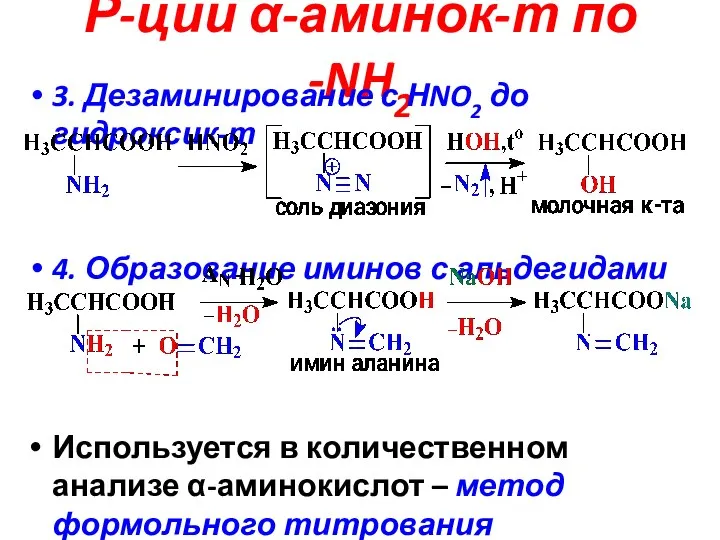
- 14. Р-ции α-аминок-т по -NH2 3. Дезаминирование с НNO2 до гидроксик-т 4. Образование иминов с альдегидами Используется
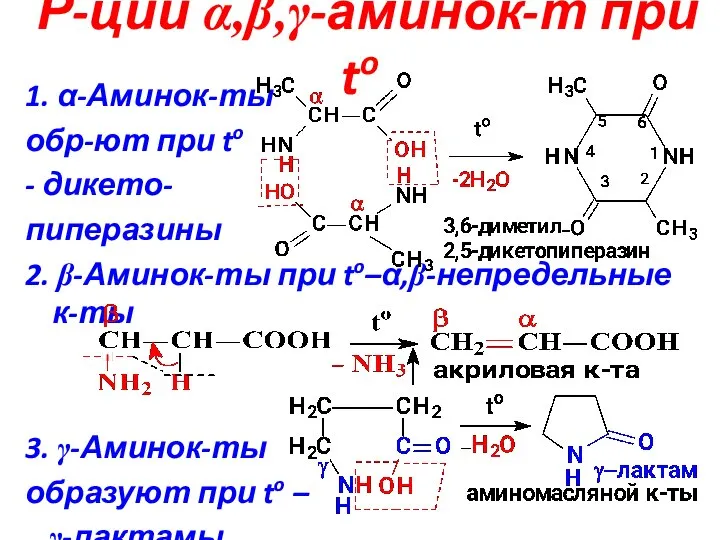
- 15. Р-ции α,β,γ-аминок-т при to 1. α-Аминок-ты обр-ют при to - дикето- пиперазины 2. β-Аминок-ты при to–α,β-непредельные
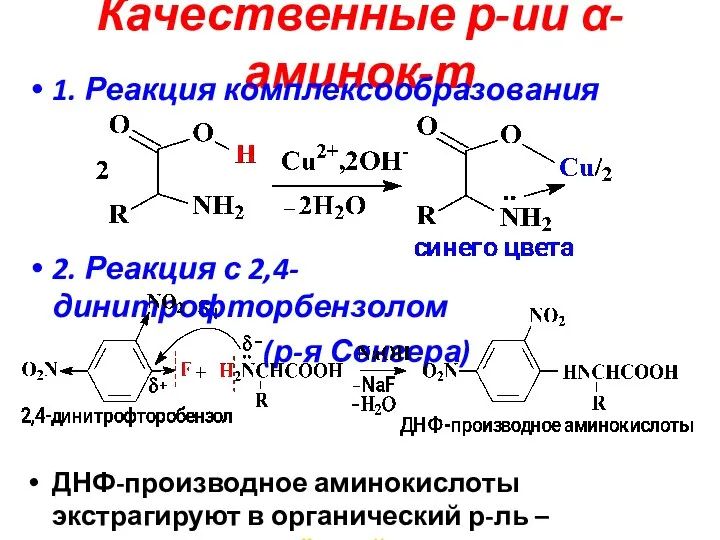
- 16. Качественные р-ии α-аминок-т 1. Реакция комплексообразования 2. Реакция с 2,4-динитрофторбензолом (р-я Сенгера) ДНФ-производное аминокислоты экстрагируют в
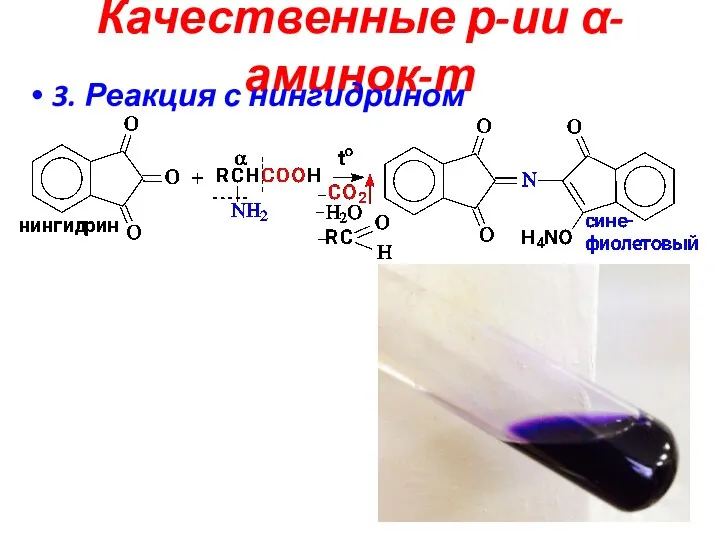
- 17. Качественные р-ии α-аминок-т 3. Реакция с нингидрином
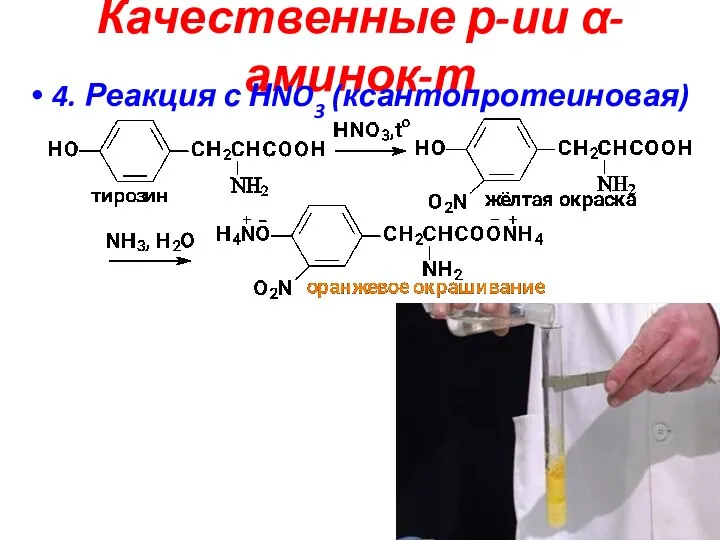
- 18. Качественные р-ии α-аминок-т 4. Реакция с НNO3 (ксантопротеиновая)
- 19. Применение аминокислот
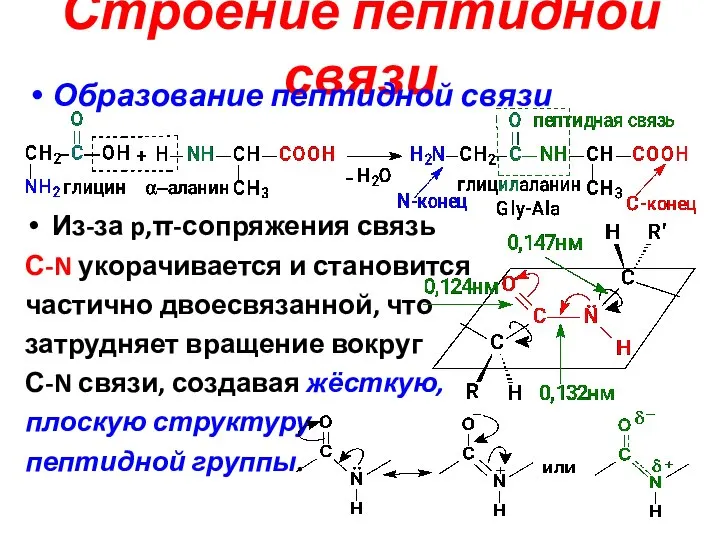
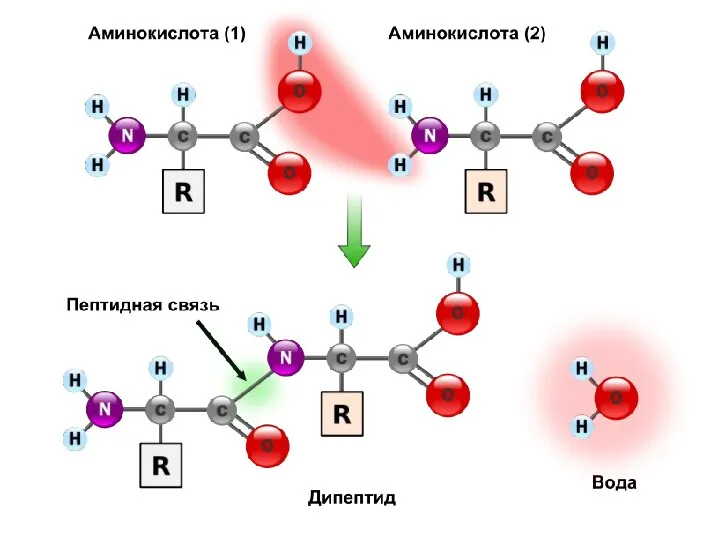
- 20. Строение пептидной связи Образование пептидной связи Из-за p,π-сопряжения связь С-N укорачивается и становится частично двоесвязанной, что
- 22. Пептидный синтез 1 ст. Защита -NH2 1-ой аминокислоты Ацилирование (SN) проводят хлорангидридами: 2 ст. Активация –СООН
- 23. Пептидный синтез 3 ст. Защита –СООН 2-ой аминокислоты 4 ст. Образование пептидной связи 5 ст. Удаление
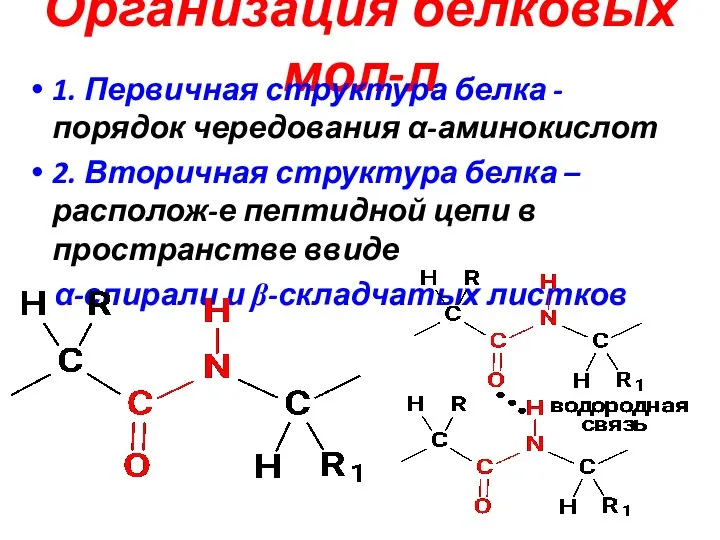
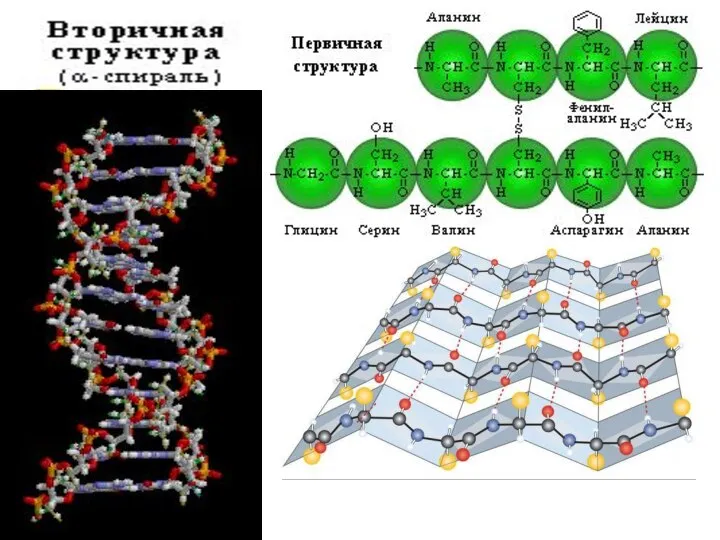
- 24. Организация белковых мол-л 1. Первичная структура белка - порядок чередования α-аминокислот 2. Вторичная структура белка –располож-е
- 27. Скачать презентацию








 Решение задач
Решение задач Строение твердых и жидких металлов. Зональная ликвация
Строение твердых и жидких металлов. Зональная ликвация Сера и ее соединения
Сера и ее соединения Проверочные работы по темам: Неметаллы. 9 класс
Проверочные работы по темам: Неметаллы. 9 класс Нефть. Черное золото или черная смерть
Нефть. Черное золото или черная смерть Закалка без полиморфного превращения
Закалка без полиморфного превращения Диссоциация оснований, кислот, солей
Диссоциация оснований, кислот, солей Презентация на тему Отравляющие вещества
Презентация на тему Отравляющие вещества  Полимеры
Полимеры Основы кристаллографии
Основы кристаллографии Классификация химических реакций
Классификация химических реакций Азот
Азот Основные понятия и законы химии
Основные понятия и законы химии Разбор ДЗ. Титрование – общие моменты
Разбор ДЗ. Титрование – общие моменты Кислород
Кислород Строение атома
Строение атома Алкены (непредельные углеводороды)
Алкены (непредельные углеводороды) Bool-doser team
Bool-doser team Химия природная или синтетическая. За и против
Химия природная или синтетическая. За и против задачи
задачи Тема: Неметаллы
Тема: Неметаллы Особо чистые вещества. Занятие 12
Особо чистые вещества. Занятие 12 Презентация на тему Серебро
Презентация на тему Серебро  Дисперсные системы
Дисперсные системы Свойства металлов, способы получения, их нахождение в природе, основные областях применения
Свойства металлов, способы получения, их нахождение в природе, основные областях применения Типы химических реакций
Типы химических реакций Гидролиз солей
Гидролиз солей Приключение кислорода
Приключение кислорода