Содержание
- 2. Девиз урока: “Химик не такой должен быть, который дальше дыму и пеплу ничего не видит, а
- 3. ПРОБЛЕМА: Реакцию можно увидеть, что она произошла, по различным признакам. Какие Признаки реакции?
- 4. ПОВТОРЕНИЕ!
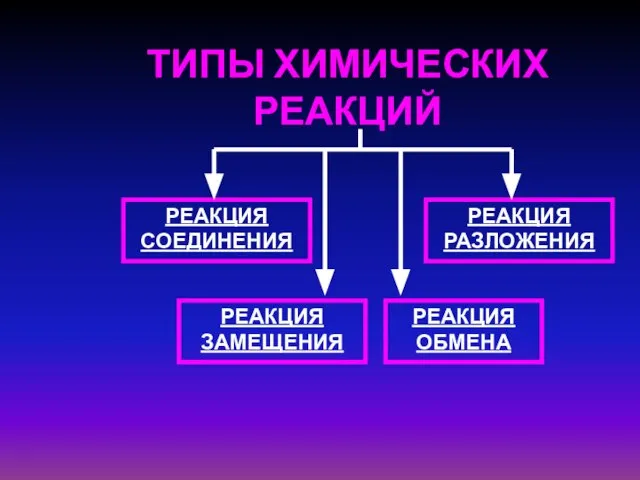
- 5. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ РЕАКЦИЯ СОЕДИНЕНИЯ РЕАКЦИЯ РАЗЛОЖЕНИЯ РЕАКЦИЯ ЗАМЕЩЕНИЯ РЕАКЦИЯ ОБМЕНА
- 6. CaO + CO2 = CaCO3 CO2 + 2NaOH = Na2CO3 + H2O Fe + S =
- 7. CaO + CO2 = CaCO3 CO2 + 2NaOH = Na2CO3 + H2O Fe + S =
- 8. 2HgO = 2Hg + O2 CaCO3 = CaO + CO2 CuSO4 + Fe = Cu +
- 9. 2H2O2 = 2H2O + O2 H2SO4+Fe(OH)2=FeSO4+2H2O BaO + SO2 = BaSO3 2HNO3+СuO=Cu(NO3)2+H2O H2SO4+2KOH=K2SO4+2H2O 2Na + H2SO4
- 10. ВНИМАНИЕ! Помни! Об этом Знает любая кроха: Безопасность- хорошо, А халатность- плохо!
- 11. Не спеши хватать прибор ты, А инструкцию читай. Убедись, что ты все понял, Вот тогда и
- 12. Пусть в пробирке пахнет воблой, В колбе- будто мармелад. Вещества на вкус не пробуй! Сладко пахнет
- 13. Скажи мне – и я забуду, Покажи мне – и я запомню, Вовлеки меня – и
- 15. Скачать презентацию











 Презентация на тему Жиры (9 класс)
Презентация на тему Жиры (9 класс)  Химические структуры
Химические структуры Общая характеристика металлов
Общая характеристика металлов Презентация на тему Обобщение: предельные и непредельные углеводороды
Презентация на тему Обобщение: предельные и непредельные углеводороды  Тест 1 задание
Тест 1 задание Химические уравнения
Химические уравнения Химические связи и взаимное влияние атомов в органических соединениях
Химические связи и взаимное влияние атомов в органических соединениях Які існують способи розділення сумішей?
Які існують способи розділення сумішей? Физическая химия поверхностных явлений
Физическая химия поверхностных явлений Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основной государственный экзамен. Химия 2021. Задание 14
Основной государственный экзамен. Химия 2021. Задание 14 Общие способы получения металлов
Общие способы получения металлов Гидролиз солей
Гидролиз солей Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ 60d677dc87dcd9320c87dd4e7b80d6ac
60d677dc87dcd9320c87dd4e7b80d6ac Презентация на тему Природные источники углеводородов и их переработка
Презентация на тему Природные источники углеводородов и их переработка  Полимеры
Полимеры Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Классификация органических веществ
Классификация органических веществ Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Основной закон радиоактивного распада и активность радионуклидов
Основной закон радиоактивного распада и активность радионуклидов Презентация на тему Полимеры. Каучуки. Резина
Презентация на тему Полимеры. Каучуки. Резина  Обобщение знаний об углеводородах
Обобщение знаний об углеводородах Занимательная химия в 8 классе
Занимательная химия в 8 классе Строение металлов и их сплавов
Строение металлов и их сплавов Предельные одноатомные спирты
Предельные одноатомные спирты Презентация на тему Этиловый спирт и его влияние на здоровье человека
Презентация на тему Этиловый спирт и его влияние на здоровье человека  Газовые смеси. Способы задания газовых смесей. Лекция 5
Газовые смеси. Способы задания газовых смесей. Лекция 5