Содержание
- 2. Ag — химический элемент с порядковым номером 47 в периодической системе. Строение атома Физические свойства Химические
- 3. Строение атома серебра 1S2 2S2 2P6 3S2 3P6 3D10 4S2 4P6 4D10 5S1 + 47 47
- 4. Физические свойства Самородок серебра Чистое серебро — белый тяжелый пластичный металл обладает самой высокой теплопроводностью и
- 5. Химические свойства 1. Ag + O2 → Ag + H2O → Аg + HCI (разб.) →
- 6. Качественная реакция на Ag + AgNO3 + HCl →AgCl↓+HNO3 Осадок белого цвета
- 7. Соединения серебра Ag Одно- Двух- Трех- валентно Ag2O – амфотерные свойства, используется для распознания органических веществ.
- 8. Применение Серебряная монета для контактов электротехнических изделий. входит в состав припоев входит в состав сплавов: для
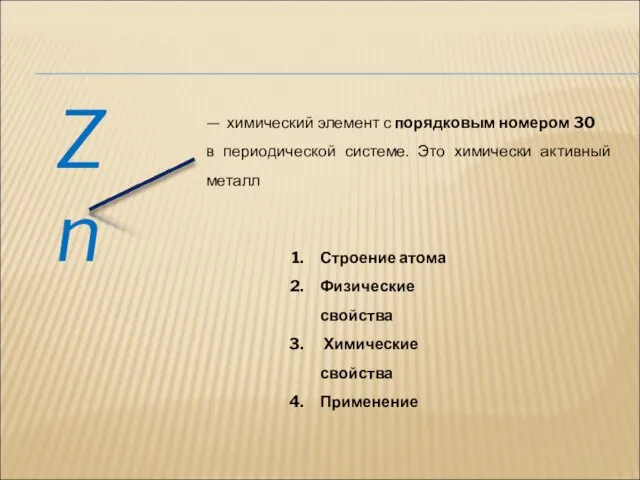
- 9. Zn — химический элемент с порядковым номером 30 в периодической системе. Это химически активный металл Строение
- 10. Строение атома цинка 30Zn + 30 1S2 2S2 2P6 3S2 3P6 3D10 4S2 2 8 18
- 11. Физические свойства Цинк (Zn) Цинк – серебристо – белый металл при комнатной температуре хрупок, но при
- 12. Химические свойства Вз - е с галогенами: Zn + Cl2 → ZnCl2 Вз – е с
- 13. Цинкование 45-60% В медицине(оксид цинка как антисептик) 10% Производство сплавов 10% Производство резиновых шин 10% Маслянные
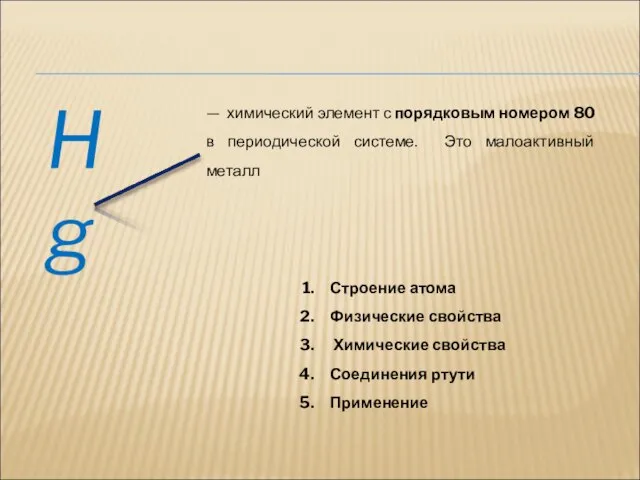
- 14. Hg — химический элемент с порядковым номером 80 в периодической системе. Это малоактивный металл Строение атома
- 15. Строение атома ртути 80Hg +80 1S2 2S2 2P6 3S2 3P6 3D10 4S2 4P6 4D10 4F14 5S2
- 16. Физические свойства Ртуть — единственный металл, жидкий при комнатной температуре. пары ртути чрезвычайно ядовиты самый легкоплавкий
- 17. Химический свойства Вз – е с неметаллами, образуются особые сплавы – амальгам. 2Hg + S →
- 18. Желтый оксид ртути (II) входит в состав глазной мази и мазей для лечения кожных заболеваний. Красный
- 20. Скачать презентацию















 Физико-химия полимеров
Физико-химия полимеров Харктеристика металлов
Харктеристика металлов Физичекие явления - основа разделения смесей в химии. 17.09.21
Физичекие явления - основа разделения смесей в химии. 17.09.21 Ацетилен
Ацетилен Презентация на тему Природный и попутный нефтяной газы, их состав, использование
Презентация на тему Природный и попутный нефтяной газы, их состав, использование  Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Ионная полимеризация
Ионная полимеризация Полиамиды (ПА)
Полиамиды (ПА) α-Аминокислоты. Биологически важные реакции α-аминокислот. Строение пептидов и белков (Лекция 26)
α-Аминокислоты. Биологически важные реакции α-аминокислот. Строение пептидов и белков (Лекция 26) Мыла и синтетические
Мыла и синтетические Лекарственные растения содержащие флавоноиды
Лекарственные растения содержащие флавоноиды Способы разделение смесей. 7 класс
Способы разделение смесей. 7 класс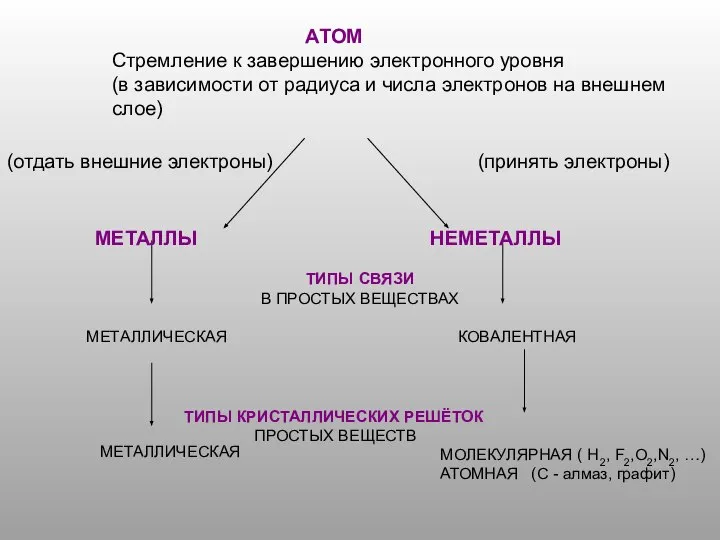 Атом. Стремление к завершению электронного уровня
Атом. Стремление к завершению электронного уровня Красители для волос. Первая группа
Красители для волос. Первая группа Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Соли. Формула соли
Соли. Формула соли Основные сведения о металлах и сплавах и их свойства
Основные сведения о металлах и сплавах и их свойства Переработка нефти
Переработка нефти Гидроксиды металлов
Гидроксиды металлов Основной государственный экзамен Химия 2021
Основной государственный экзамен Химия 2021 Кинетика химических реакций
Кинетика химических реакций Сложные реакции
Сложные реакции 8-12 химические реакции
8-12 химические реакции Химическое равновесие и способы его смещения. Принцип Ле Шателье. 9 класс
Химическое равновесие и способы его смещения. Принцип Ле Шателье. 9 класс Свойства воды. Физические свойства
Свойства воды. Физические свойства Химия в нашей жизни
Химия в нашей жизни Аллотропные модификации
Аллотропные модификации Классификация неорганических веществ
Классификация неорганических веществ