Содержание
- 2. Угольная кислота Химическая формула - H2CO3 Кислота слабая, существует только в водном растворе, очень непрочная, разлагается
- 3. Угольная кислота Двухосновная, образует соли: -средние – карбонаты (ионы CO32-) - кислые – гидрокарбонаты (ионы НCO3-)
- 4. Соли угольной кислоты карбонаты твёрдые кристаллические вещества. большинство из них в воде не растворяются Диссоциация: с
- 5. Химические свойства карбонатов и гидрокарбонатов 1) Качественная реакция на CO32- карбонат – ион "вскипание" при действии
- 6. Качественные реакции Чтобы проверить наличие карбонатов необходимо добавить любую кислоту СаСО3 + 2Н+ ↔ Са2+ +
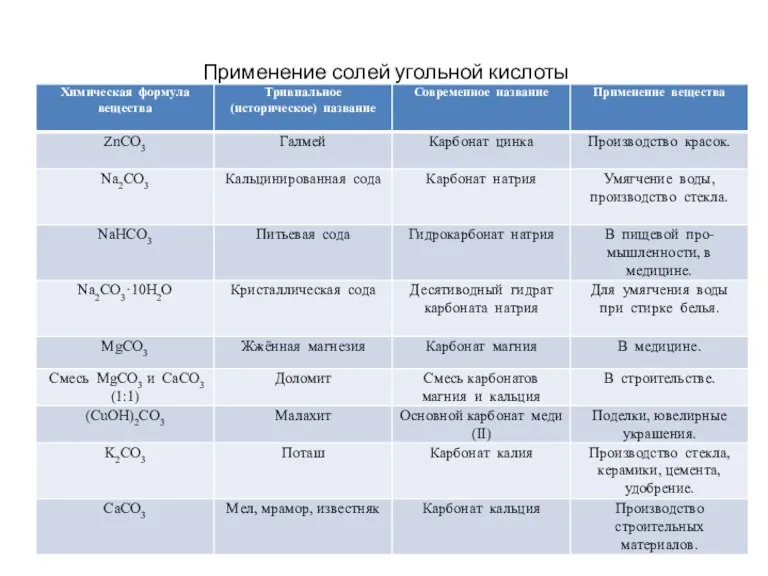
- 7. Применение солей угольной кислоты
- 9. Скачать презентацию





 Средства для мытья окон
Средства для мытья окон Алканы. Этан
Алканы. Этан Изучение свойств азотной кислоты для учащихся 9 классов
Изучение свойств азотной кислоты для учащихся 9 классов Строение вещества. Эксперименты
Строение вещества. Эксперименты Моющие и чистящие средства
Моющие и чистящие средства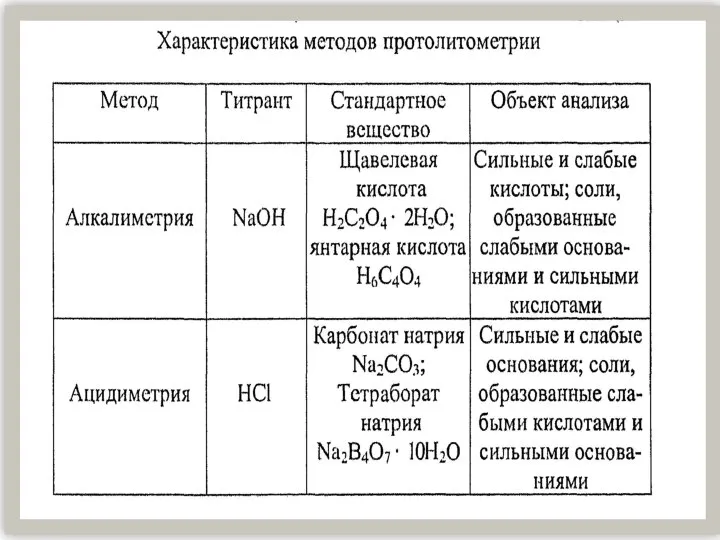 Характеристика методов протолитометрии
Характеристика методов протолитометрии Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Чистые вещества и смеси
Чистые вещества и смеси Сухой лёд
Сухой лёд Химические реакции
Химические реакции Невидиме чорнило
Невидиме чорнило Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Распространение ПВО в приземном слое атмосферы
Распространение ПВО в приземном слое атмосферы Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Количество вещества - моль
Количество вещества - моль Шаблон для презентации по химии
Шаблон для презентации по химии Истина - дочь времени, а не авторитета
Истина - дочь времени, а не авторитета Железо
Железо Анализ объектов окружающей среды. Сопоставление и выбор методов анализа
Анализ объектов окружающей среды. Сопоставление и выбор методов анализа Выбор материала для изготовления зубчатых колес
Выбор материала для изготовления зубчатых колес ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Химические методы. Золь-гель метод
Химические методы. Золь-гель метод ЭОР в преподавании химии
ЭОР в преподавании химии Алкины
Алкины Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Ароматические углеводороды - Арены
Ароматические углеводороды - Арены Соединения щелочноземельных металлов
Соединения щелочноземельных металлов