Содержание
- 2. ОСНОВАНИЯ ОПРЕДЕЛЕНИЕ; КЛАССИФИКАЦИЯ; ХИМИЧЕСКИЕ СВОЙСТВА.
- 3. Основания - сложные вещества, состоящие из атомов металлов, связанных с одной или несколькими гидроксогруппами ОН. n
- 4. Выберите формулы оснований. Назовите их. НСl, NaOH, Na2O, Ca(OH)2, H2SO4, P2O5, Fe(OH)3, MgO, Cи(OH)2
- 5. Основания NaOH – гидроксид натрия Ca(OH)2 – гидроксид кальция Fe(OH)3 – гидроксид железа (III) Cи(OH)2 –
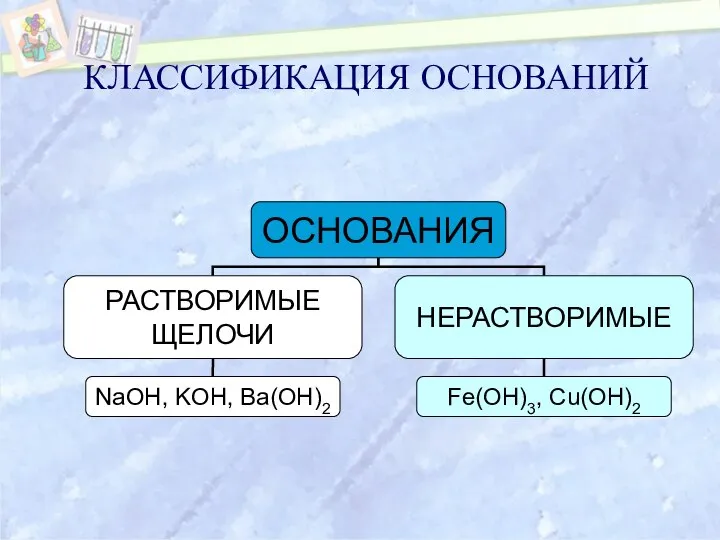
- 6. КЛАССИФИКАЦИЯ ОСНОВАНИЙ
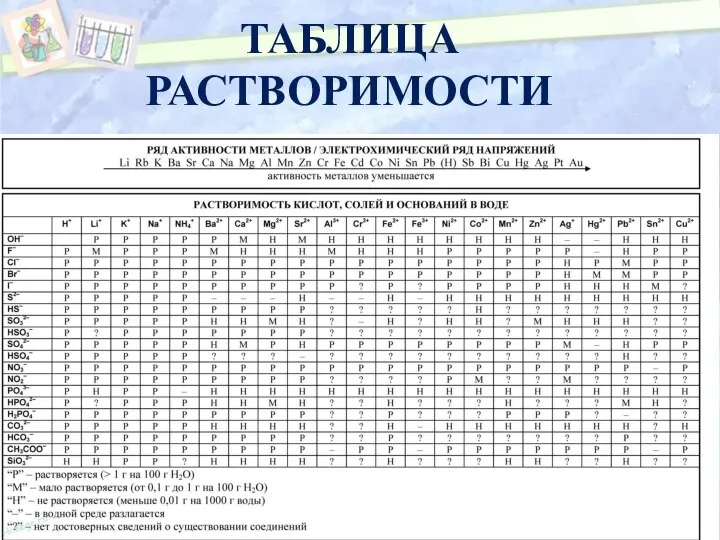
- 7. ТАБЛИЦА РАСТВОРИМОСТИ
- 8. Однокислотные NaOH, KOH Двухкислотные Pb(OH)2, Fe(OH)2 Трехкислотные Al(OH)3 Классификация оснований по числу гидроксогрупп. Основания
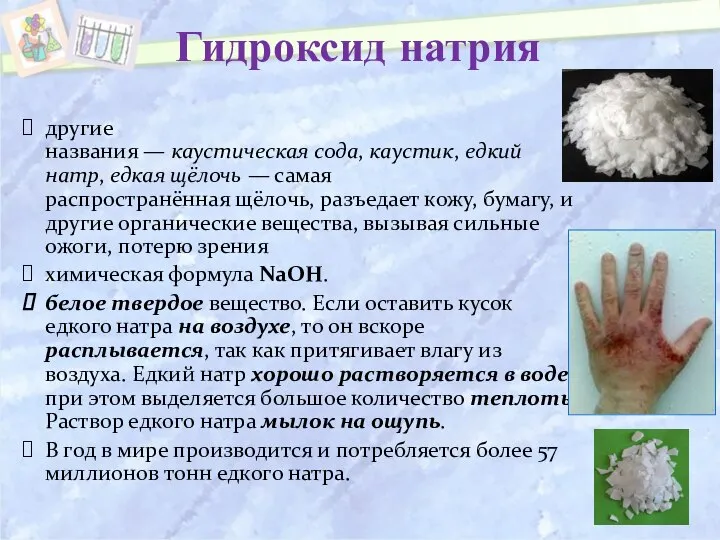
- 9. Гидроксид натрия другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь — самая распространённая щёлочь,
- 10. Историческая справка о NaOH До XVII века щёлочью (фр. alkali) называли также карбонаты натрия и калия.
- 11. Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: в целлюлозно-бумажной промышленности для делигнификации
- 12. Гидроксид калия «калиевый щёлок» — KOH. Тривиальные названия: едкое кали, каустический поташ. Бесцветные, очень гигроскопичные кристаллы,
- 13. Гашёная известь – рыхлый белый порошок, немного растворимый в воде. Получается при взаимодействии негашёной извести СаО
- 14. Правила техники безопасности при работе с щелочами: Щелочи – едкие вещества, разъедают кожу, дерево, бумагу. Гидроксид
- 15. Все моющие средства, мыло, шампунь это слабощелочные растворы. Именно щелочная среда создает эффект мылкости, растворяет жир
- 16. Щелочной раствор гидроксида кальция Са(ОН)2 (гашеная известь) мы наносим на стены при побелке. На основе нерастворимых
- 17. Получение оснований 1) Активный металл + вода: 2Na + 2H2O = 2NaOH + H2 2) Оксид
- 18. Напишите уравнения возможных реакций, укажите тип реакции и названия полученных веществ. К + H2O → ВaO
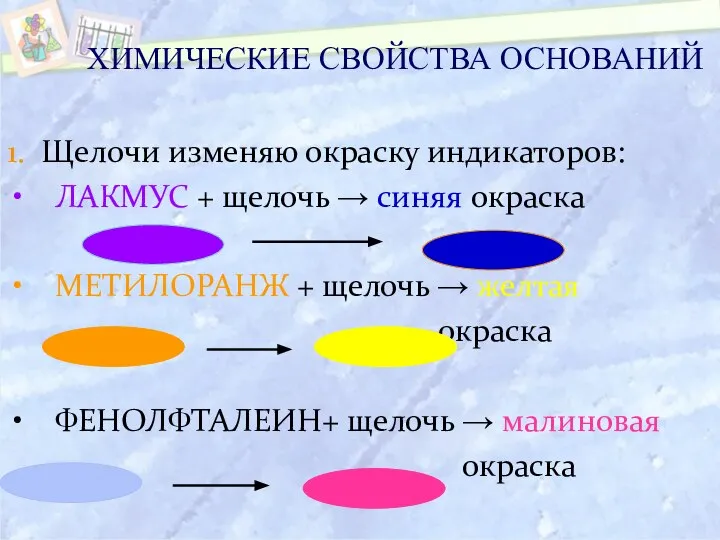
- 19. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 1. Щелочи изменяю окраску индикаторов: ЛАКМУС + щелочь → синяя окраска МЕТИЛОРАНЖ +
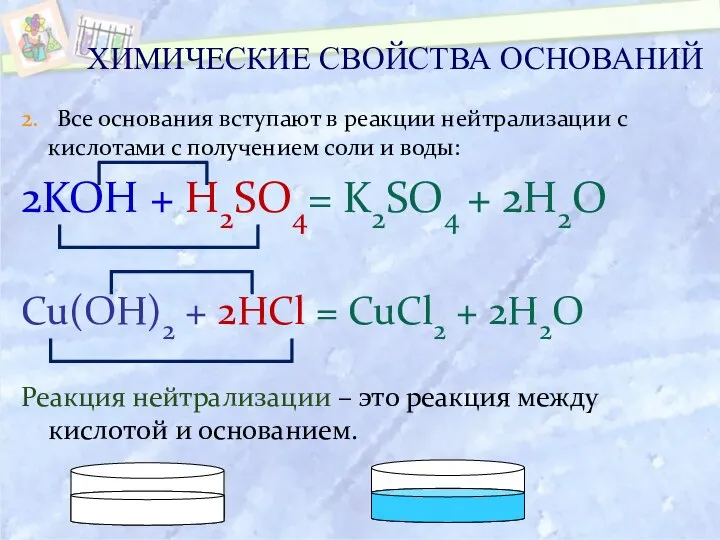
- 20. 2. Все основания вступают в реакции нейтрализации с кислотами с получением соли и воды: 2KOH +
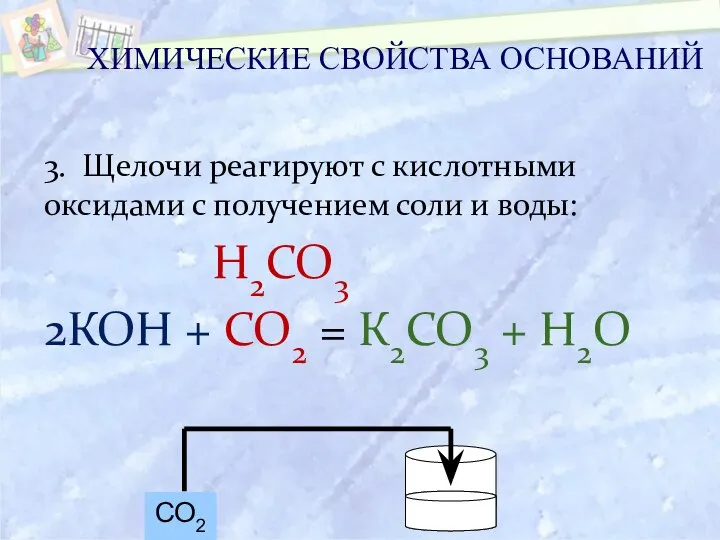
- 21. 3. Щелочи реагируют с кислотными оксидами с получением соли и воды: Н2СО3 2КОН + СО2 =
- 22. Щелочи реагируют с растворимыми солями, если одно из полученных веществ выпадает в осадок. 2КОН + Сu(NO3)2
- 23. 4. Нерастворимые основания при нагревании разлагаются на оксид металла и воду. Валентность металла сохраняется: t° Сu(ОН)2
- 24. Подумай! С какими из перечисленных веществ реагирует гидроксид калия: Фосфорная кислота; Гидроксид кальция; Магний; Оксид лития;
- 26. Скачать презентацию

















 Презентация на тему Поверхностно-активные вещества
Презентация на тему Поверхностно-активные вещества  Полезные ископаемые
Полезные ископаемые Разминка
Разминка Презентация на тему Неорганические кислоты
Презентация на тему Неорганические кислоты  Минеральные компоненты молока и молочных продуктов. Макроэлементы
Минеральные компоненты молока и молочных продуктов. Макроэлементы Предельные углеводороды - алканы
Предельные углеводороды - алканы Химия в быту
Химия в быту Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Углеводороды (УВ)
Углеводороды (УВ) Магматические горные породы
Магматические горные породы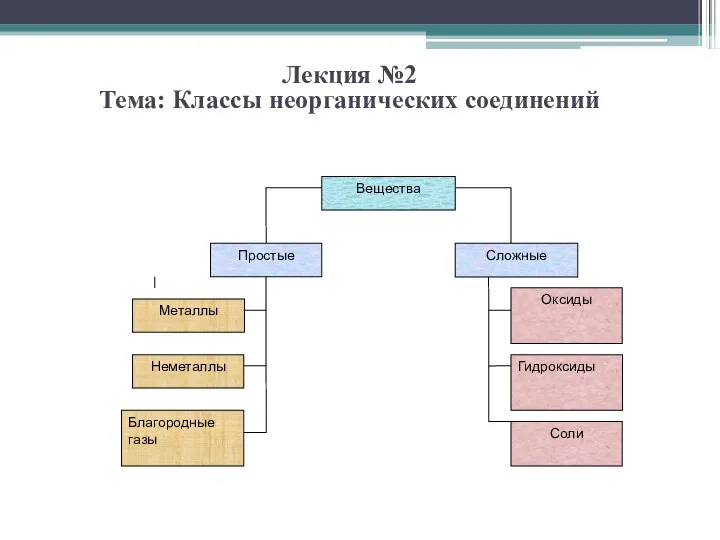 Лекция 2 Классы неорганических соединений (1)
Лекция 2 Классы неорганических соединений (1) Соли
Соли Алканы
Алканы Количество вещества
Количество вещества Кислоты в химии
Кислоты в химии Атом
Атом Хімія в стоматології
Хімія в стоматології Моделирование состава биоплёночного материала
Моделирование состава биоплёночного материала Электролит
Электролит Кислород – это самый распространенный на нашей планете элемент
Кислород – это самый распространенный на нашей планете элемент Cложные реакции. Лекция 3
Cложные реакции. Лекция 3 Природные источники углеводородов
Природные источники углеводородов Экстракция и кристаллизация
Экстракция и кристаллизация Металлы. Общие свойства
Металлы. Общие свойства Классификация органических веществ
Классификация органических веществ Амины. Аминокислоты
Амины. Аминокислоты Химическая кинетика
Химическая кинетика Соль - без вины виновата
Соль - без вины виновата