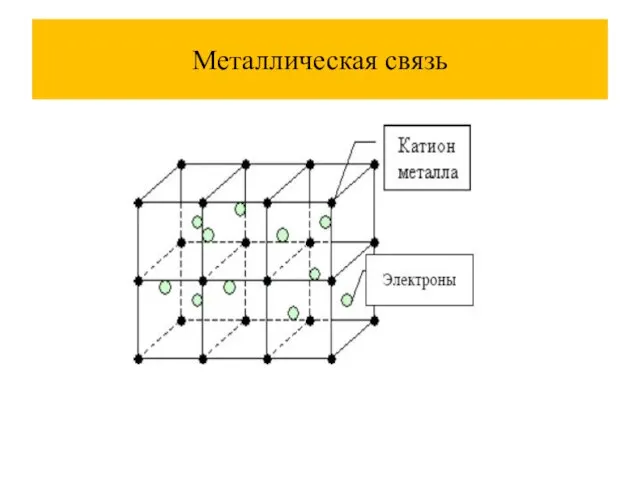
Слайд 2Химическая связь
Ионная связь- происходит полный переход электрона от одного атома к другому,

электроотрицательность атомов сильно различается
Ковалентная неполярная связь - происходит образование общей электронной пары, пара в общей степени принадлежит обоим атомам( молекула образуется из одинаковых атомов), электроотрицательность атомов одинакова
Ковалентная полярная связь - происходит образование общей электронной пары, пара в разной степени принадлежит обоим атомам( молекула образуется из разных атомов), электроотрицательность атомов различаются
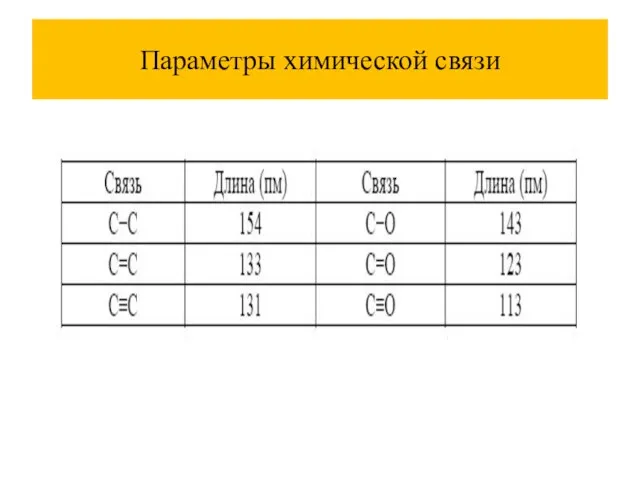
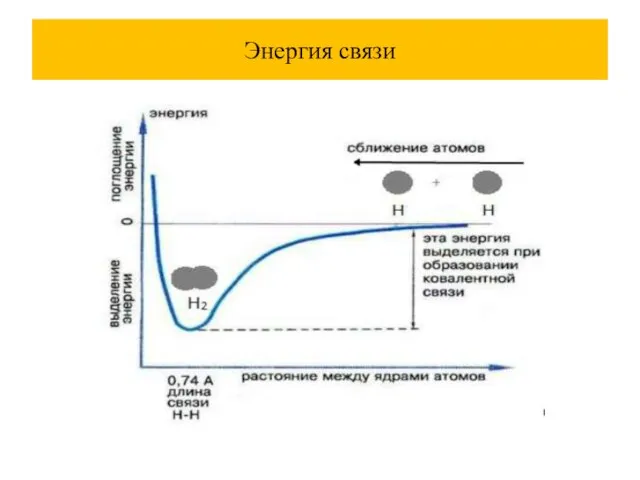
Слайд 6Параметры химической связи
химическое соединение образуется только в том случае, когда это выгодно

энергетически. Силы притяжения преобладают над силами отталкивания, потенциальная энергия взаимодействующих атомов понижается.
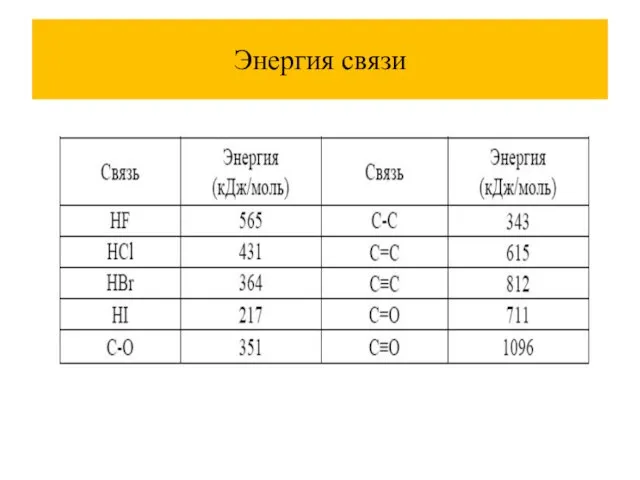
энергия связи- это та энергия, которая необходима для разъединения атомов в молекуле и для удаления их друг от друга на расстояние, на котором их взаимодействие невозможно
Слайд 16Энергия ионной кристаллической решетки

Слайд 17Энергия ионной кристаллической решетки

Слайд 18Энергия ионной кристаллической решетки

Слайд 23Зависимость свойств веществ от поляризация ионов

Слайд 24Зависимость свойств веществ от поляризация ионов

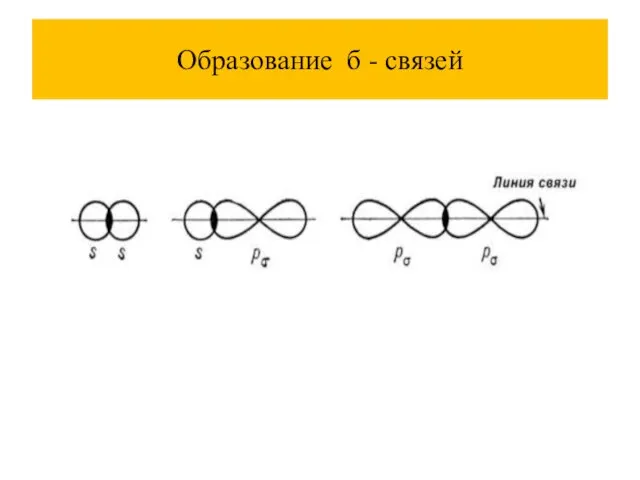
Слайд 26Характеристики ковалентная связь

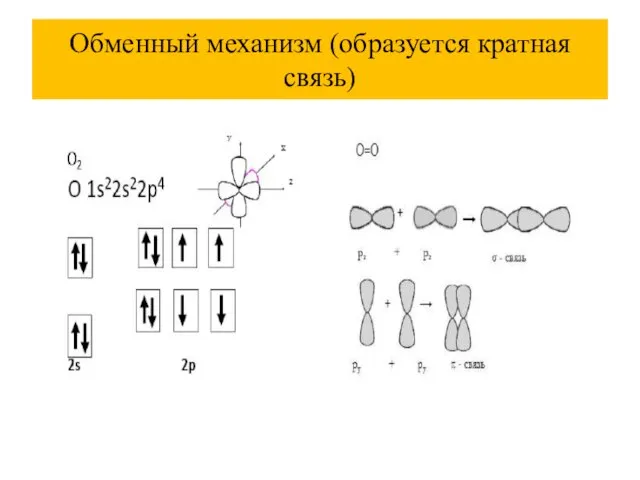
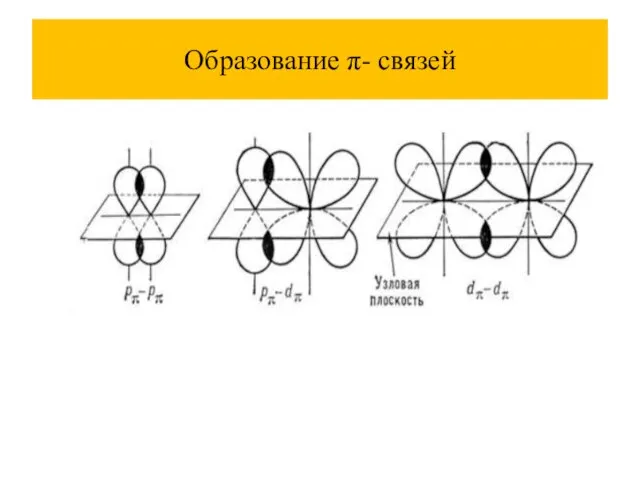
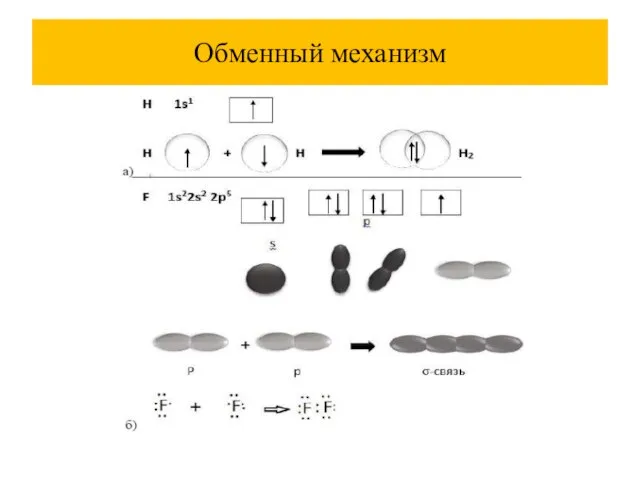
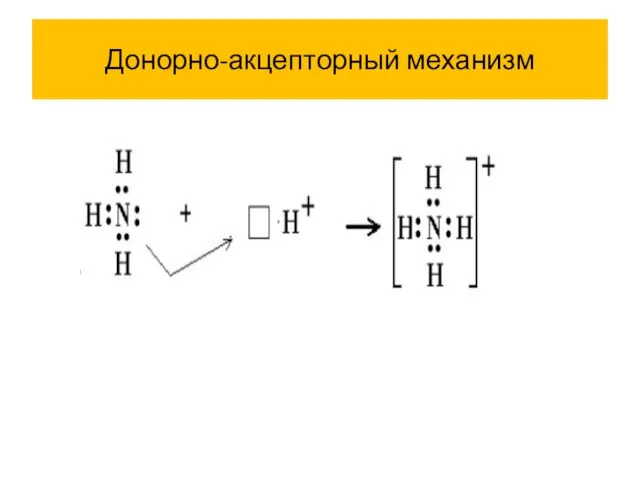
Слайд 32Обменный механизм (образуется кратная связь)
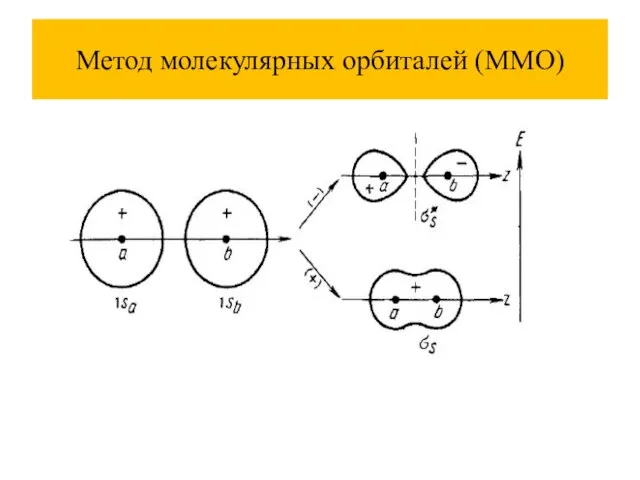
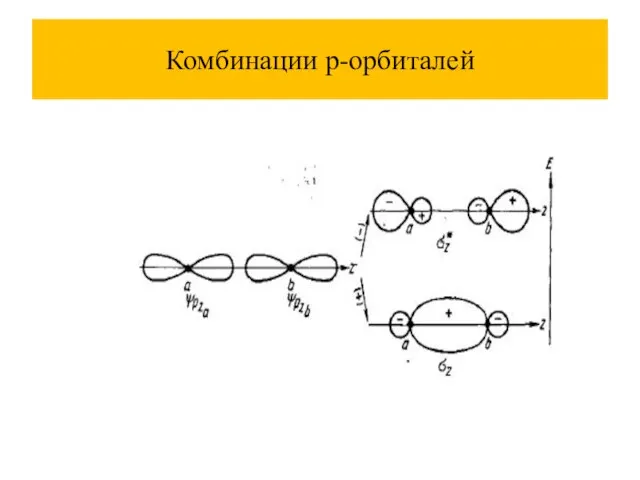
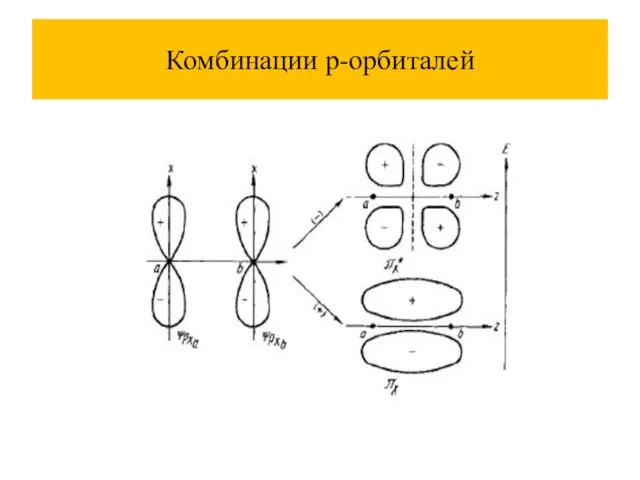
Слайд 39Метод молекулярных орбиталей (ММО)
Основные положения
Каждый электрон находится в поле всех ядер, связь

делокализована.
Связь не обязательно образована парой электронов.
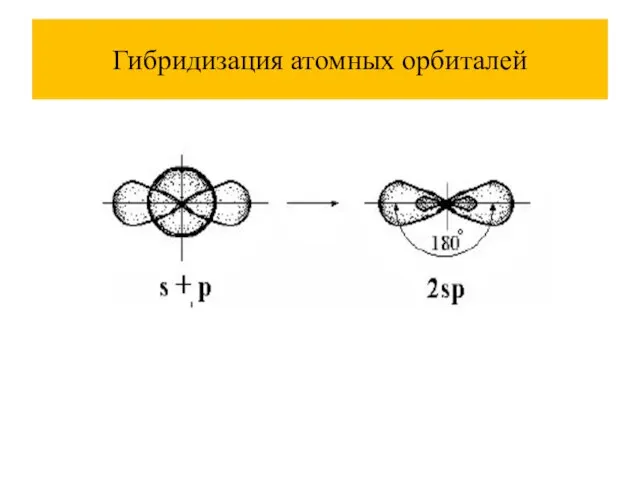
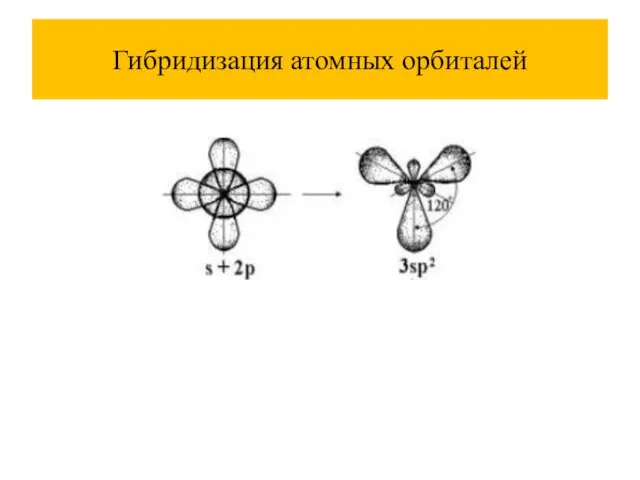
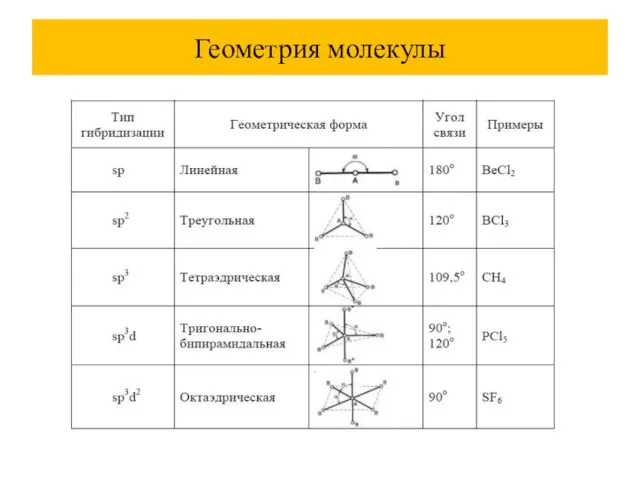
При комбинации атомных орбиталей (АО) образуются молекулярные орбитали (МО), их количество равно сумме атомных.
Электроны на молекулярных орбиталях размещаются по тем же принципам, что и на атомных орбиталях .
Молекулярные орбитали называют: связывающие, разрыхляющие, несвязывающие
Слайд 40Метод молекулярных орбиталей (ММО)

Слайд 41Метод молекулярных орбиталей (ММО)
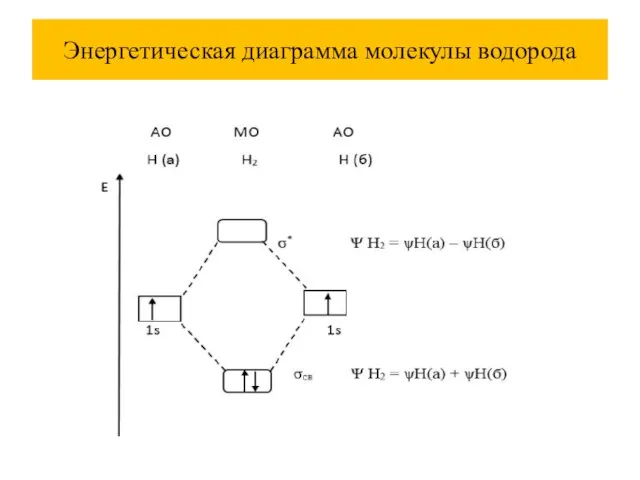
Слайд 42Энергетическая диаграмма молекулы водорода
Слайд 44Энергетическая диаграмма образования молекулярных ионов водорода

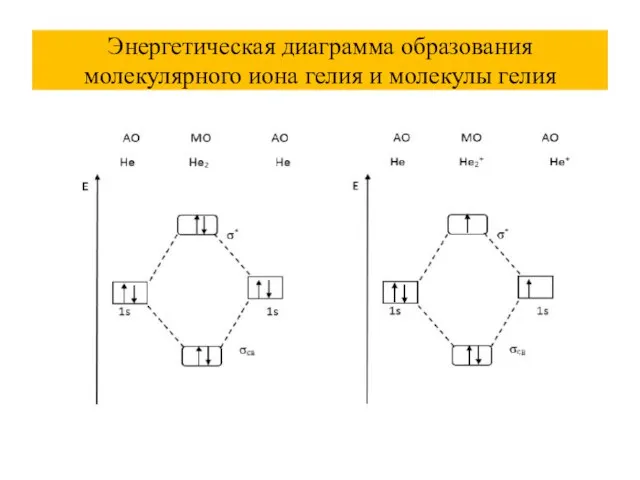
Слайд 45Энергетическая диаграмма образования молекулярного иона гелия и молекулы гелия
Слайд 48Электронная формула молекулы кислорода

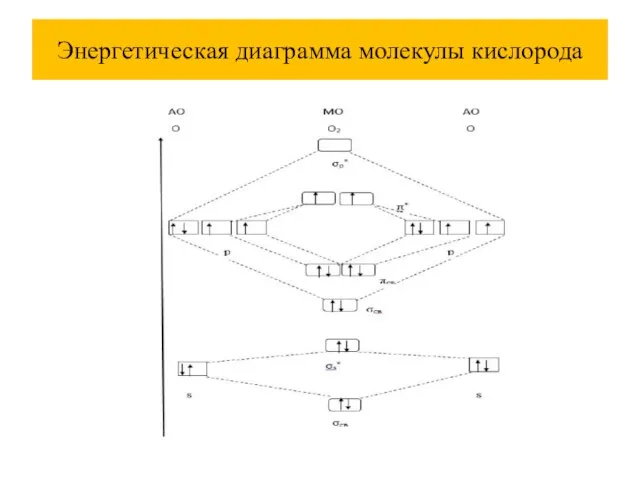
Слайд 49Энергетическая диаграмма молекулы кислорода
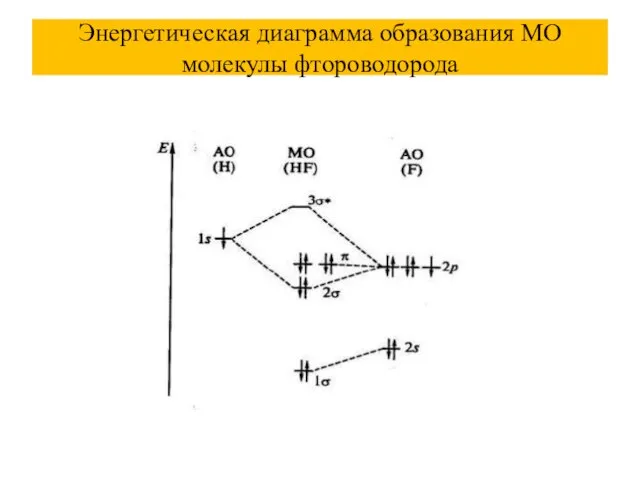
Слайд 54Энергетическая диаграмма образования МО молекулы фтороводорода
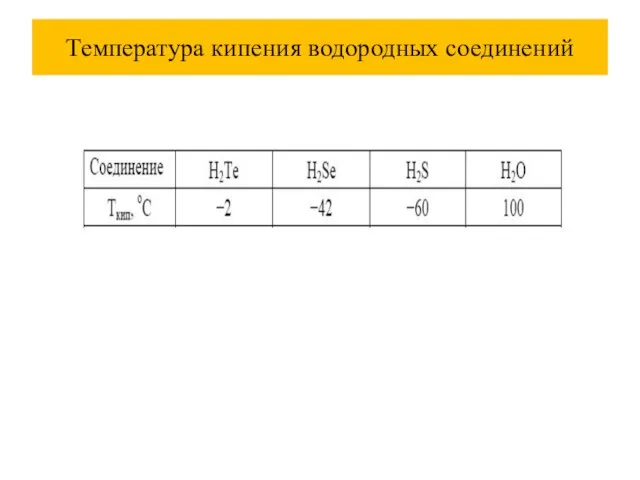
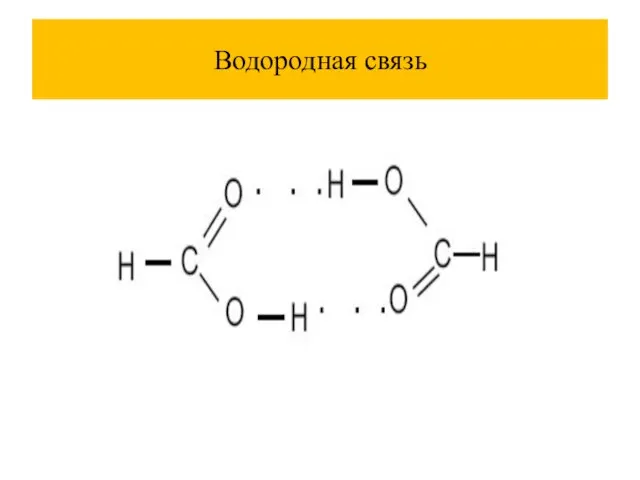
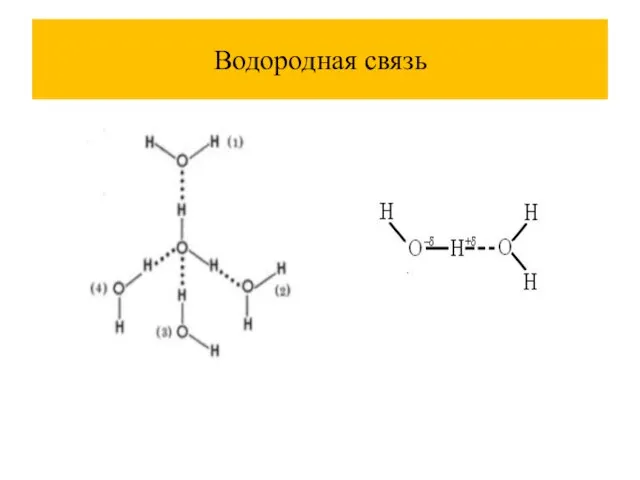
Слайд 60Температура кипения водородных соединений















































 Сера и ее соединения
Сера и ее соединения Ниобий. Химические свойства
Ниобий. Химические свойства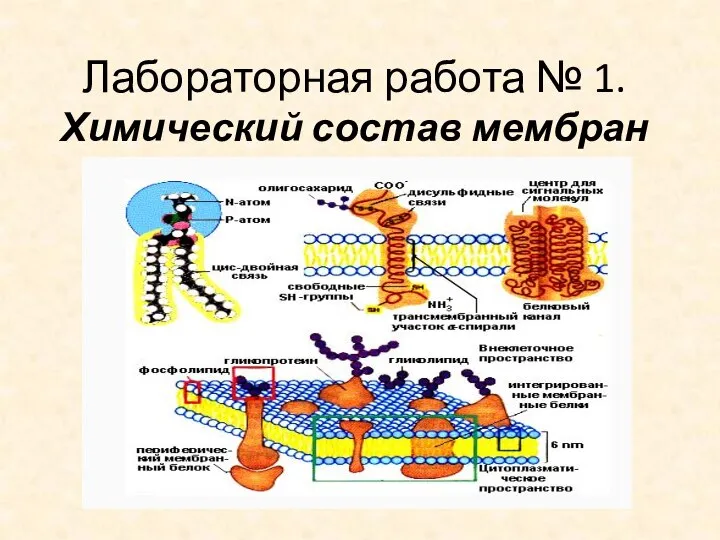 Химический состав мембран. Лабораторная работа № 1
Химический состав мембран. Лабораторная работа № 1 Твердые электролиты
Твердые электролиты Химия в быту
Химия в быту Уравнения химических реакций
Уравнения химических реакций Презентация на тему Биополимеры
Презентация на тему Биополимеры  Лекция № 1
Лекция № 1 Хлор
Хлор Получение меди
Получение меди Химия и сельское хозяйство
Химия и сельское хозяйство Альдегиды и кетоны
Альдегиды и кетоны Понятие о пестицидах. Меры безопасности при работе с ядами
Понятие о пестицидах. Меры безопасности при работе с ядами Галогены. Положение галогенов в ПСХЭ
Галогены. Положение галогенов в ПСХЭ Рубидий (Rb). Цезий (Cs). Франций (Fr)
Рубидий (Rb). Цезий (Cs). Франций (Fr) Здравствуйте, химия! Что изучает химия
Здравствуйте, химия! Что изучает химия Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности Взаимодействие кислот с металлами. Кислоты-окислители
Взаимодействие кислот с металлами. Кислоты-окислители Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды
Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды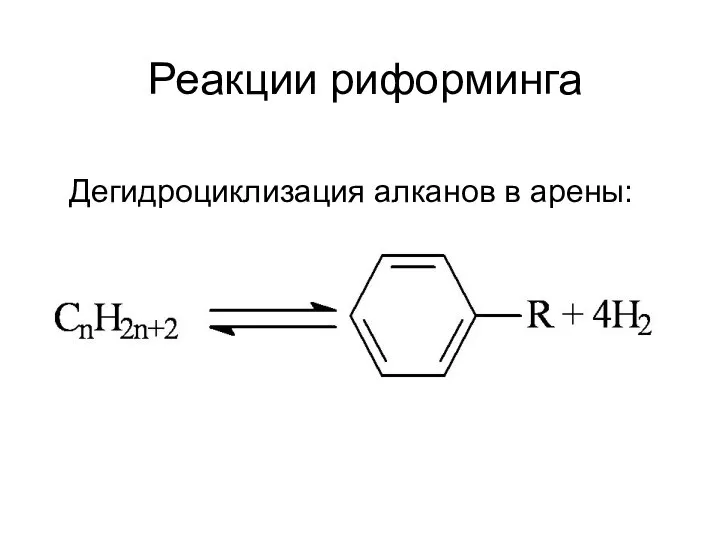 Реакции риформинга
Реакции риформинга Презентация на тему Переработка нефти
Презентация на тему Переработка нефти  Предельные углеводороды. Алканы (1)
Предельные углеводороды. Алканы (1) Азотная кислота и ее соли. Специфические свойства азотной кислоты
Азотная кислота и ее соли. Специфические свойства азотной кислоты Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов
Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов Кальций
Кальций Опыты по теме Свойства основных классов неорганических соединений
Опыты по теме Свойства основных классов неорганических соединений Теория электролитической диссоциации
Теория электролитической диссоциации Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов
Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов