Слайд 2Химическая связь - взаимодействие атомов, связывающее их в единую устойчивую систему (молекулу,

ион, кристалл и др.)
Слайд 3Если число электронов на внешнем уровне атома максимальное, то такой уровень называется

завершённым. Такие атомы не вступают в химическое взаимодействие при обычных условиях. Это благородные газы, находящиеся в главной подгруппе 8 группы Периодической системы.
Внешние электронные уровни атомов других хим. элементов являются незавершенными. Они стремятся довести его до 8-электронного.
Электроны внешнего энергетического уровня являются валентными. При взаимодействии этих электронов образуется химическая связь.
В молекуле электроны становятся общими
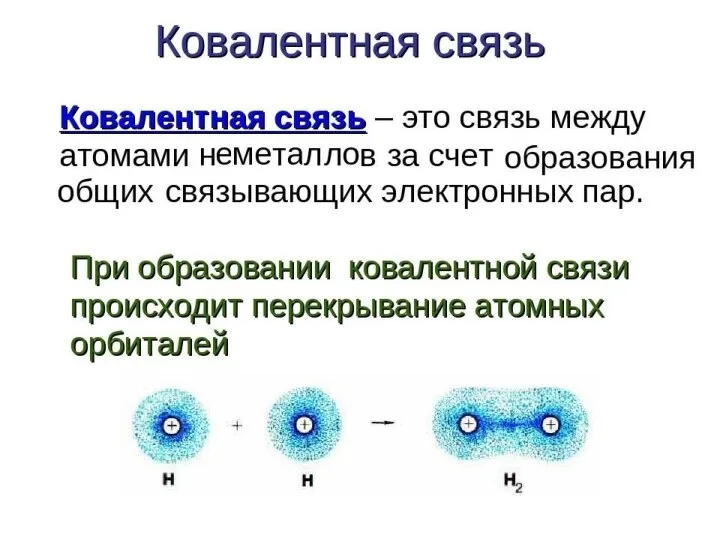
Слайд 7Способы перекрывания электронных облаков:

Слайд 8Характеристики ковалентной связи:
Энергия связи – энергия, которую необходимо затратить для разрыва данной

связи. Измеряется в кДж/моль. Зависит от радиуса перекрывающихся облаков.
Кратность связи – число химических связей между двумя атомами. Её можно показать сплошной линией между атомами либо точками. Чем больше кратность связи, тем прочнее связь.
Длина связи – расстояние между ядрами атомов в молекуле. Измеряется в нм.
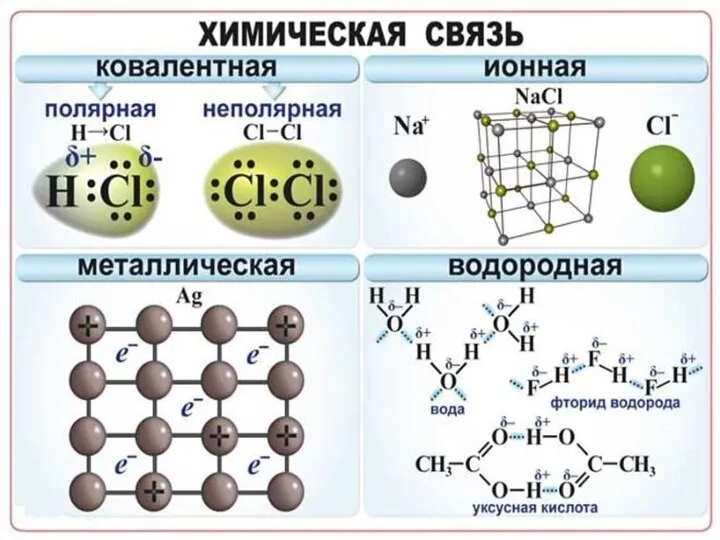
Полярность связи – смещение общей электронной плотность к более электроотрицательному атому. В зависимости от этого ковалентная связь делится на полярную и неполярную
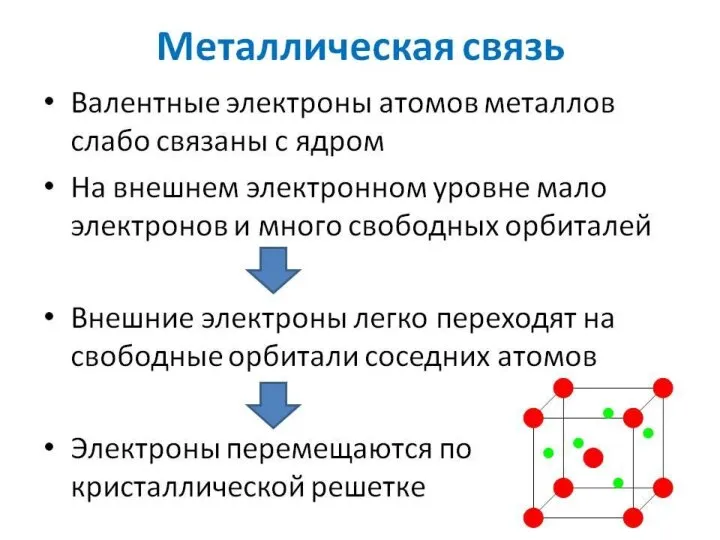
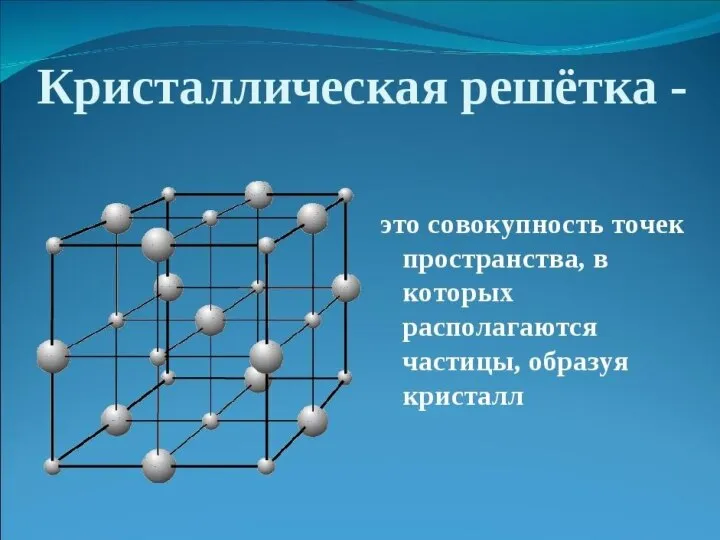
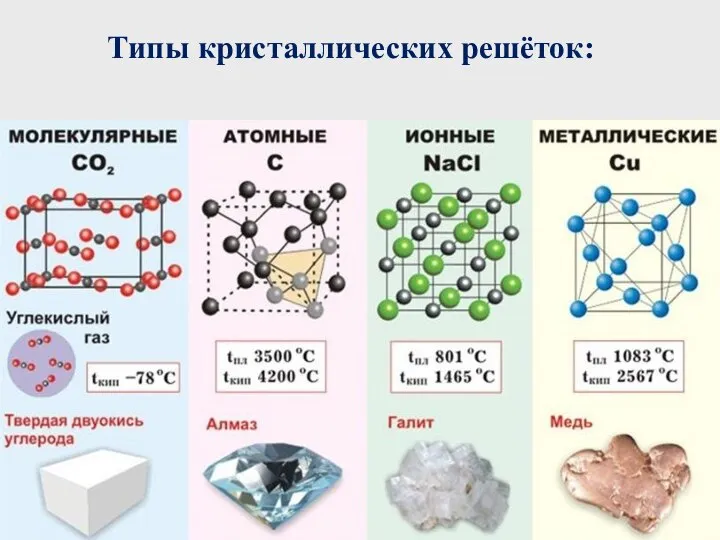
Слайд 11Металлическая связь - химическая связь в металлах и их сплавах, обусловленная наличием
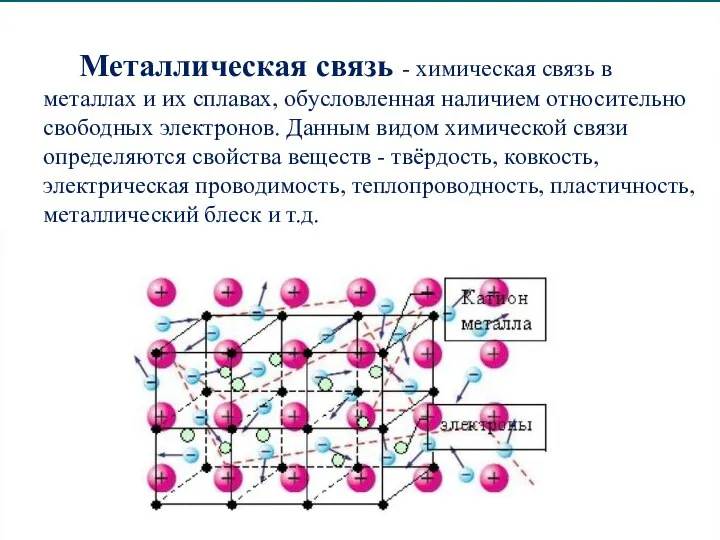
относительно свободных электронов. Данным видом химической связи определяются свойства веществ - твёрдость, ковкость, электрическая проводимость, теплопроводность, пластичность, металлический блеск и т.д.
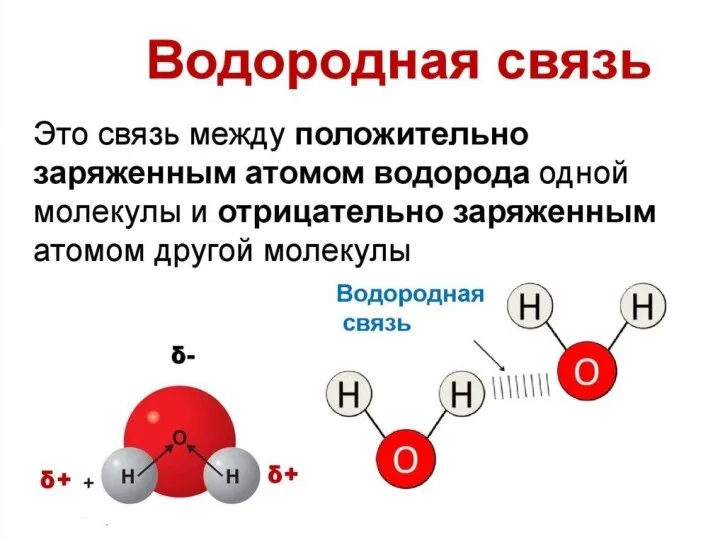
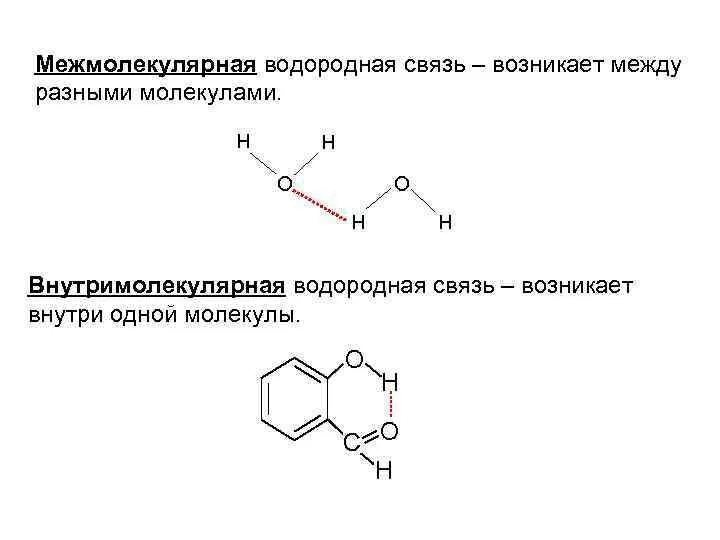
Слайд 15Наличие водородной связи обуславливает физические и химические свойства вещества - высокие температуры

плавления и кипения, хорошую растворимость, высокую испаряемость. Связь слабая и легко рвётся, но множество таких связей способно породить силу, на которой, в буквальном смысле, держится всё живое. Примеры соединений с водородной связью - спирты, карбоновые кислоты, амины, аминокислоты, белки, вода, аммиак, фтороводород










 Презентация на тему Количество вещества. Молярная масса
Презентация на тему Количество вещества. Молярная масса  Свинец
Свинец Строение атома и ПСХЭ. Повторение 9 класс
Строение атома и ПСХЭ. Повторение 9 класс Применение алкинов
Применение алкинов Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1)
Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1) Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Реакции ионного обмена
Реакции ионного обмена Обобщение. Неметаллы
Обобщение. Неметаллы Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Химия и производство. Химическая промышленность
Химия и производство. Химическая промышленность Кислоты
Кислоты Оптические свойства веществ
Оптические свойства веществ 1399920
1399920 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химия на войне
Химия на войне Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Графит (С)
Графит (С) Презентация на тему Алюминий и его соединения
Презентация на тему Алюминий и его соединения  Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи
Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи Азот. Физические свойства азота
Азот. Физические свойства азота Химия в игре. Проектная работа
Химия в игре. Проектная работа Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Спирты
Спирты Изомерия
Изомерия Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот