Содержание
- 2. Строение атома железа. Fe (железо) Порядковый номер: 26 Период: IV Группа: VIII Подгруппа: побочная Электронное строение
- 3. Физические свойства Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0С Температура кипения
- 4. 4.Химические свойства а) Взаимодействие с простыми веществами +3 -2 +2 -2 1.3Fe+2O2 = Fe2O3 * FeO
- 5. б) Взаимодействие со сложными веществами с разбавленными кислотами: 0 +1 -1 +2 -1 0 Fe +
- 6. с концентрированной кислотой реагирует при нагревании, без нагревания кислоты пассивируют железо: 0 +6 t +3 +4
- 7. c cолями (в водном растворе) 0 +2 +2 0 Fe + CuSO4=FeSO4+Cu
- 8. c парами воды 0 +1 +3 +2 0 3Fe + 4H2O =Fe2O3 FeO + 4H2
- 9. Внимание! Обратите внимание, что во всех реакциях идущих при нагревании железо окисляется до +3
- 10. Качественные реакции на ион +2 Fe: 2 + 2+ 1. Fe Cl2+2 NaOH=Fe(OH)2 +2NaCl осадок зеленоватого
- 11. Реакция с красной кровяной солью 2. 3 Fe SO4 +2K3[Fe(CN)6]=Fe3[Fe(CN)6 ]2 +3K2 SO4 красная синий осадок
- 12. Качественные реакции на ион +3 Fe: 3+ 3+ 1. FeCl3+3NaOH= Fe(OH)3+3NaCl осадок бурого цвета
- 13. Реакция с жёлтой кровяной солью 3+ 1+ 4- 3+ 4- 2. 4FeCl3 + 3K4[Fe(CN)6]=Fe4[Fe(CN)6]3 +12KCl желтая
- 14. Реакция с роданидом калия 3+ 1- 1+ 1- 2+ 1- 3. FeCl3 + K(NCS) = [
- 15. Нахождение в природе. Халькопирит с включениями кварца Приморский край Пирит
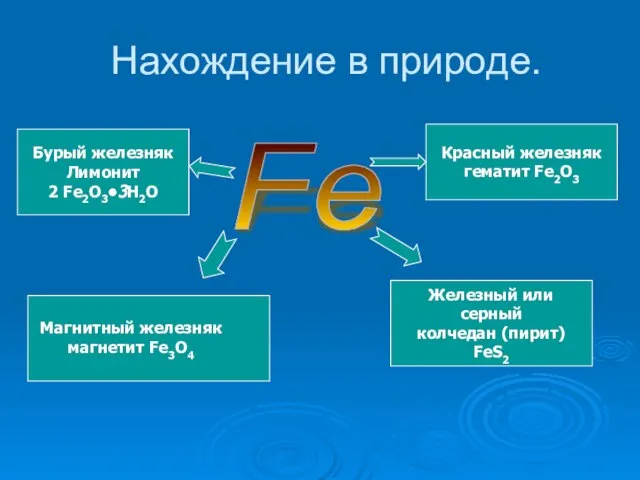
- 16. Нахождение в природе. Fe Магнитный железняк магнетит Fe3O4 Красный железняк гематит Fe2O3 Бурый железняк Лимонит 2
- 17. Применение железа химически чистое железо не коррозирует, такое железо применяют в электротехнике (сердечники в магнитах) Широко
- 19. Скачать презентацию









![Реакция с красной кровяной солью 2. 3 Fe SO4 +2K3[Fe(CN)6]=Fe3[Fe(CN)6 ]2 +3K2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/874143/slide-10.jpg)





 1
1 Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Природа и классификация химических связей
Природа и классификация химических связей Методы активации карбоксильной группы
Методы активации карбоксильной группы Химическая промышленность. Аварии на химических предприятиях
Химическая промышленность. Аварии на химических предприятиях bc95487a97b0472591b20aef8d569081
bc95487a97b0472591b20aef8d569081 Сплавы металлов (познавательная презентация)
Сплавы металлов (познавательная презентация) Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы
Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы Фторопласты и их использование
Фторопласты и их использование Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5 Графический диктант. Азот и Аммиак
Графический диктант. Азот и Аммиак Флэшмоб: Лаборатория на кухне
Флэшмоб: Лаборатория на кухне Процессы переработки нефти
Процессы переработки нефти Общие вопросы материаловедения
Общие вопросы материаловедения Электрохимическая коррозия
Электрохимическая коррозия Циклоалканы (полиметиленовые, циклопарафины, ациклические)
Циклоалканы (полиметиленовые, циклопарафины, ациклические) Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции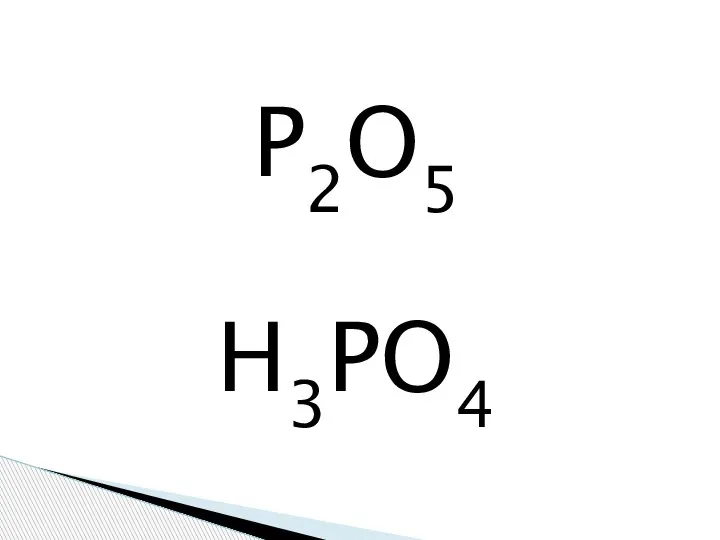 Фосфорная кислота
Фосфорная кислота Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Вода И её значение
Вода И её значение Презентация на тему Производство стекла
Презентация на тему Производство стекла  Генетическая связь веществ. Виды реакций
Генетическая связь веществ. Виды реакций Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ Атом. Изотопы
Атом. Изотопы Химическая связь (лекция 4)
Химическая связь (лекция 4) Молекулы. Свойства молекул
Молекулы. Свойства молекул Химия, химия, химия!
Химия, химия, химия! Магний и его сплавы
Магний и его сплавы