Содержание
- 2. Теория электролитической диссоциации была создана шведским ученым С. Аррениусом в 1883 году Механизм электролитической диссоциации был
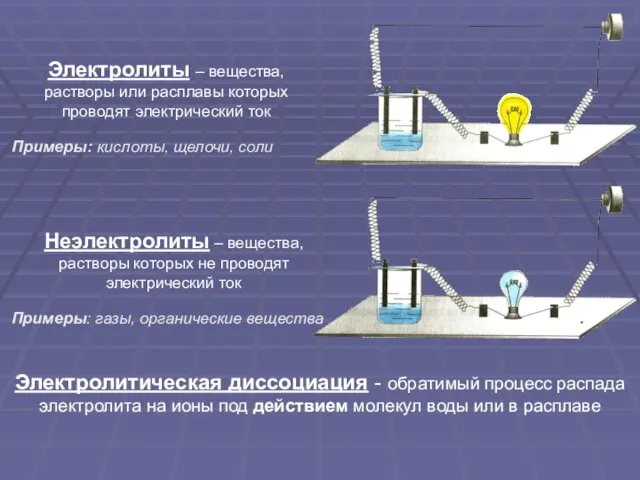
- 3. Электролиты – вещества, растворы или расплавы которых проводят электрический ток Неэлектролиты – вещества, растворы которых не
- 4. Молекулы воды представляют собой диполи, так как атомы водорода расположены под углом 104,5 градуса, благодаря чему
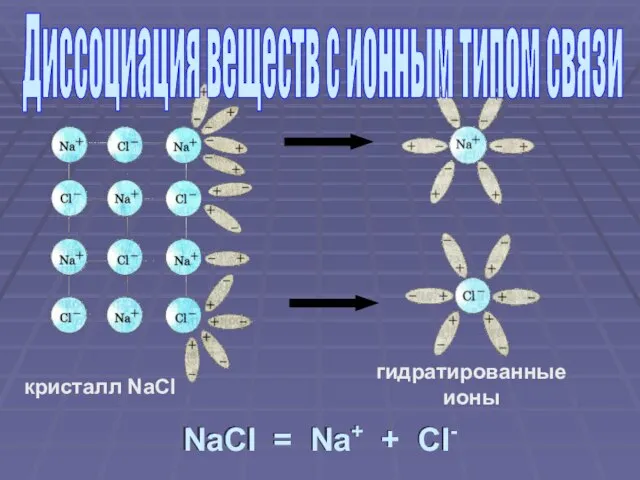
- 5. кристалл NaCl гидратированные ионы NaCl = Na+ + Cl- Диссоциация веществ с ионным типом связи
- 6. Ориентация молекул – диполей воды около ионов кристалла Взаимодействие молекул воды с противоположно заряженными ионами поверхностного
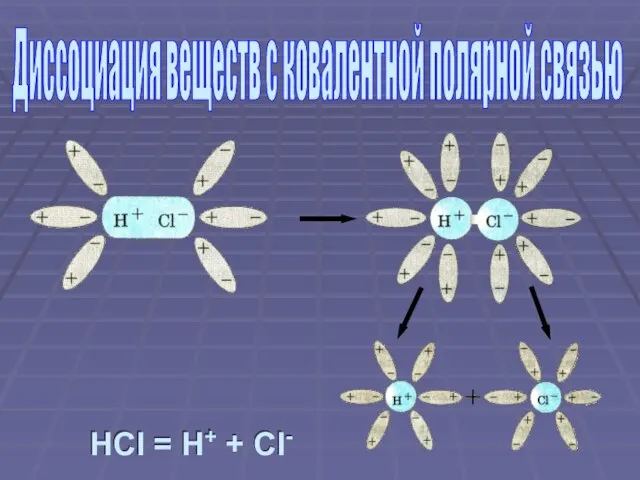
- 7. HCl = H+ + Cl- Диссоциация веществ с ковалентной полярной связью
- 8. Ориентация молекул воды вокруг полюсов молекулы электролита Взаимодействие молекул воды с противоположно заряженными ионами поверхностного слоя
- 9. слабые > 30 % сильные 2 − 30 % средней силы Степень электролитической диссоциации зависит от
- 10. Основные положения теории электролитической диссоциации При растворении в воде электролиты диссоциируют на положительные и отрицательные ионы
- 11. HSO3− H+ + SO32− Кислоты – электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного
- 12. Основания – электролиты, которые при диссоциации образуют катионы металла и анионы гидроксогрупп ОН- NaOH = Na+
- 13. Средние соли – сильные электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы
- 14. Вещества, растворы которых проводят электрический ток. Процесс распада электролита на ионы. Положительно заряженные ионы. Отрицательно заряженные
- 16. Скачать презентацию










 Презентация на тему Уголь
Презентация на тему Уголь  Кислород. Нахождение в природе. Свойства. 8 класс
Кислород. Нахождение в природе. Свойства. 8 класс 4.1-2 Генетическая связь+
4.1-2 Генетическая связь+ Презентация на тему Химическая связь и её типы
Презентация на тему Химическая связь и её типы  Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова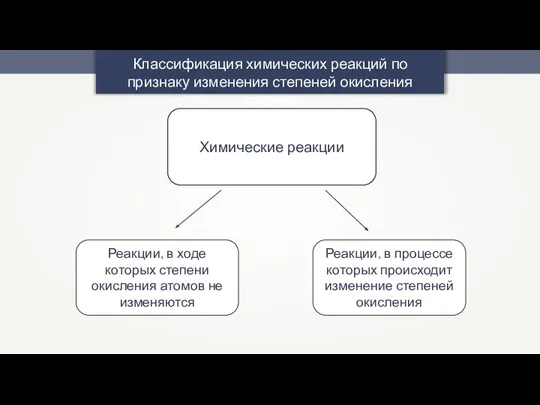 Окислительно-восстановительные реакции. Электролиз
Окислительно-восстановительные реакции. Электролиз Дисахариды и полисахариды
Дисахариды и полисахариды Валентность
Валентность Полимеры. Применение
Полимеры. Применение Классификация химических реакций
Классификация химических реакций Алкены. Пентен- С5Н10
Алкены. Пентен- С5Н10 Пименов_Химический состав
Пименов_Химический состав Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики Синтез 7,7 - дихлоробицикло [4.1.0] гептана
Синтез 7,7 - дихлоробицикло [4.1.0] гептана Коррозия металлов
Коррозия металлов Составы и температуры плавления смесей
Составы и температуры плавления смесей Основания. Простые и сложные ионы
Основания. Простые и сложные ионы Закономерности протеканий химических реакций
Закономерности протеканий химических реакций Интересные факты о химических элементах
Интересные факты о химических элементах Основные законы химии
Основные законы химии Кислород
Кислород Участь антиоксидантної системи saccharomyces cerevisiae у горметичному ефекті пероксиду водню
Участь антиоксидантної системи saccharomyces cerevisiae у горметичному ефекті пероксиду водню Эксергетический баланс
Эксергетический баланс Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Физические механизмы образования кристаллов
Физические механизмы образования кристаллов Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2)
Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2) Энергетическая диаграмма орбиталей многоэлектронного атома
Энергетическая диаграмма орбиталей многоэлектронного атома Окислительно-восстановительные реакции
Окислительно-восстановительные реакции