Содержание
- 2. Атомы благородных газов имеют завершённый внешний энергетический уровень. Он наиболее устойчив и стабилен, что является причиной
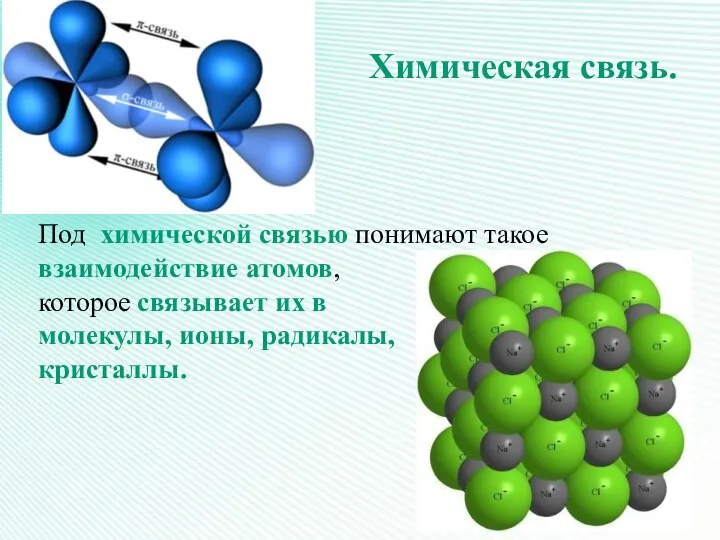
- 3. Химическая связь. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы,
- 4. Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы.
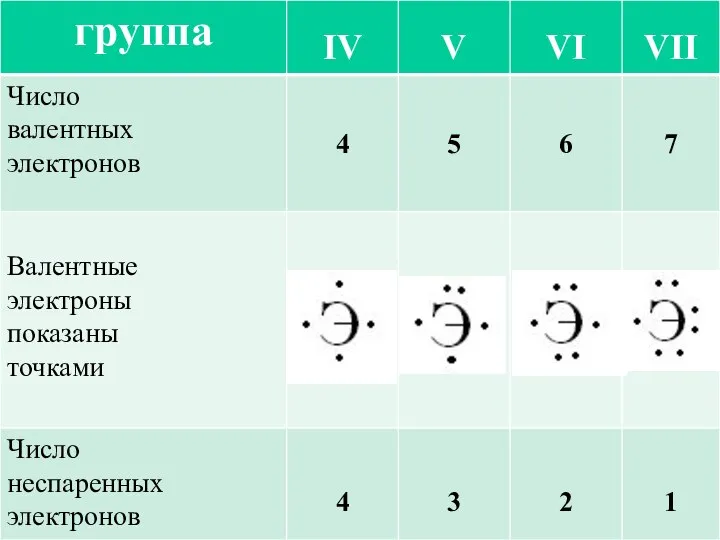
- 5. Валентность – это способность атома элемента образовывать различное число химических связей с другими атомами. Величина валентности
- 6. В образовании химической связи участвуют только валентные электроны. У элементов главных подгрупп это электроны внешнего энергетического
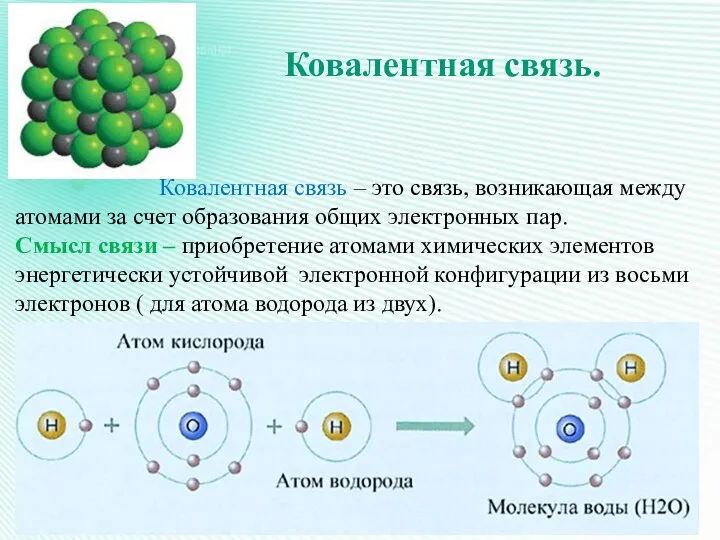
- 8. Ковалентная связь. Ковалентная связь – это связь, возникающая между атомами за счет образования общих электронных пар.
- 9. В образовании ковалентной связи принимают участие неспаренные валентные электроны атома, которые располагаются на внешнем уровне по
- 11. Механизм образования ковалентной связи Неспаренные электроны Общая или поделённая пара электронов Между ядрами образуется сгущение отрицательного
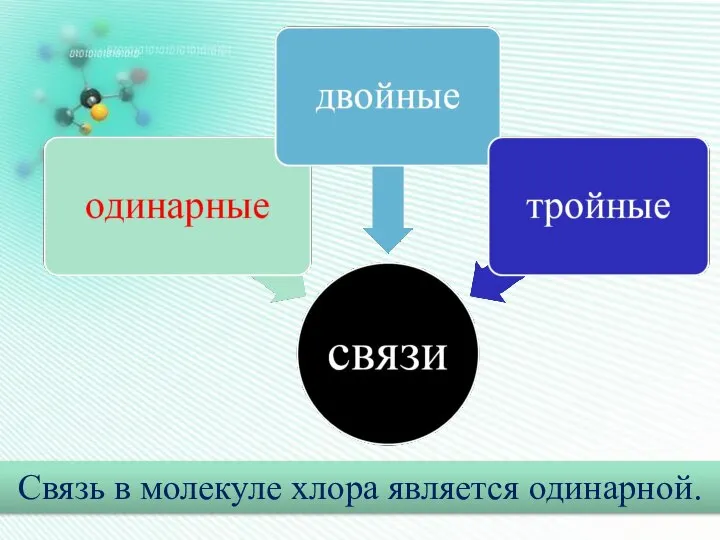
- 12. Образование ковалентной связи в молекуле хлора (Cl2). +17Cl 2е- 8е- 7е- Для завершения внешнего слоя каждому
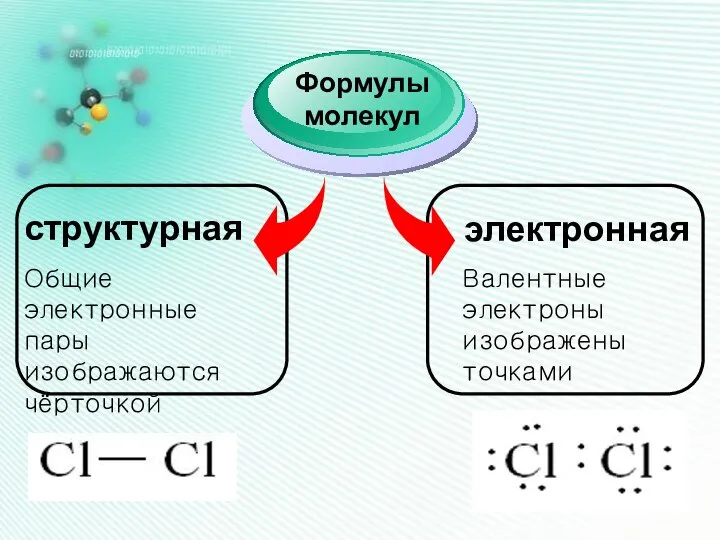
- 13. структурная Формулы молекул электронная Общие электронные пары изображаются чёрточкой Валентные электроны изображены точками
- 14. Связь в молекуле хлора является одинарной.
- 15. Образование молекулы азота (N2). +7N 2е- 5е- В молекуле азота образуется тройная связь, значит атом азота
- 16. Образование молекулы хлороводорода (HCl). +1Н 1е- +17Cl 2е- 8е- 7е- Водород и хлор в молекуле хлороводорода
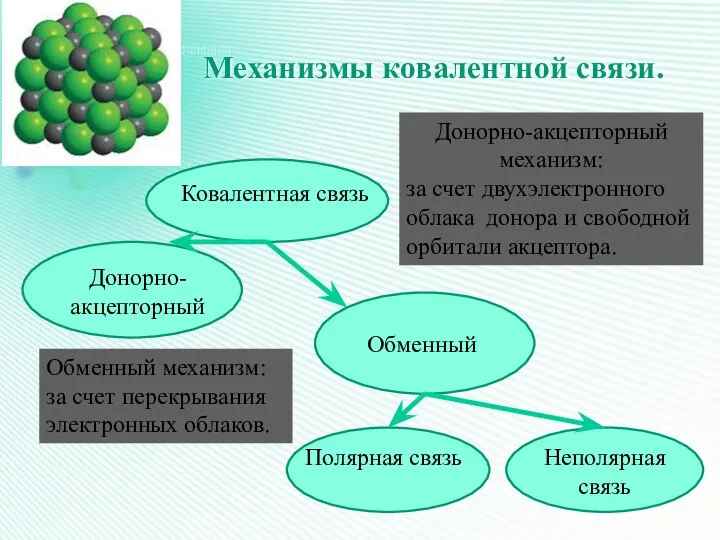
- 18. Механизмы ковалентной связи. Ковалентная связь Донорно-акцепторный Обменный Полярная связь Неполярная связь Обменный механизм: за счет перекрывания
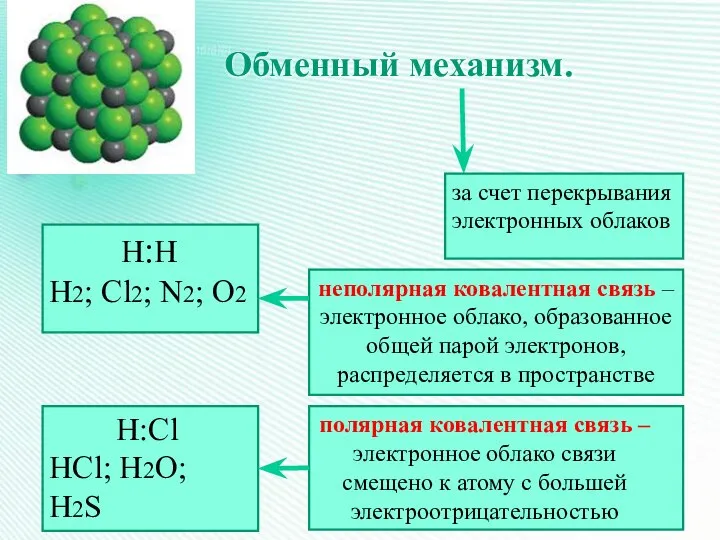
- 19. Обменный механизм. за счет перекрывания электронных облаков Н:Н Н2; Cl2; N2; O2 неполярная ковалентная связь –
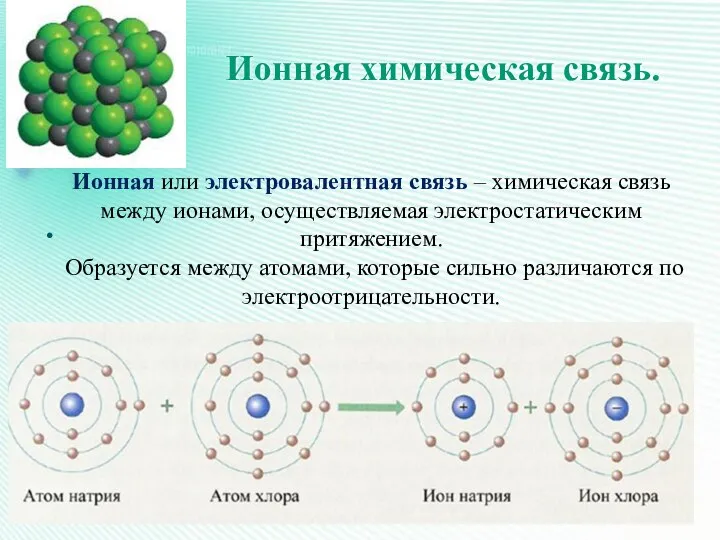
- 20. Ионная химическая связь. Ионная или электровалентная связь – химическая связь между ионами, осуществляемая электростатическим притяжением. Образуется
- 21. Как правило, ионная связь возникает между атомами металлов и неметаллов.
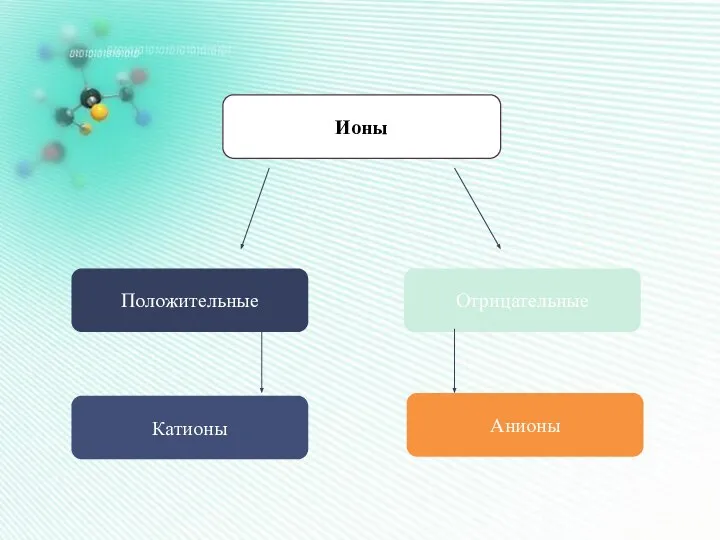
- 22. Ионы Положительные Отрицательные Катионы Анионы
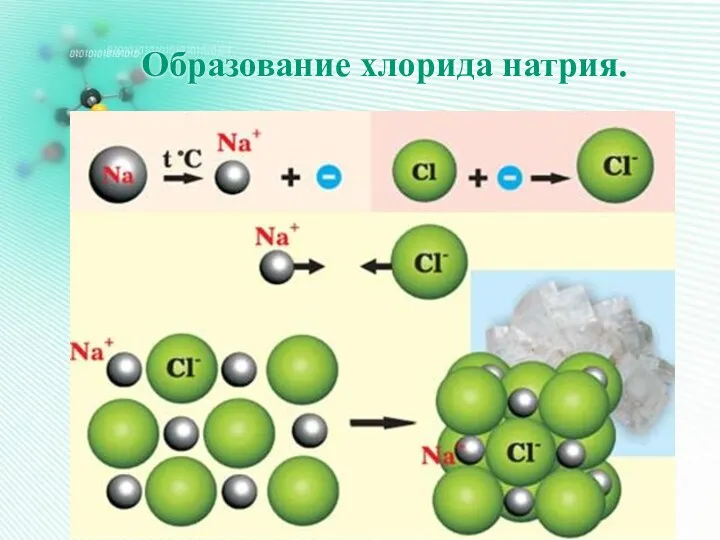
- 23. Образование хлорида натрия.
- 25. Скачать презентацию












 Генетические ряды неорганических соединений
Генетические ряды неорганических соединений Техника безопасности на уроках химии
Техника безопасности на уроках химии Задачи. Химические элементы
Задачи. Химические элементы Соль не только блюдо
Соль не только блюдо Генетические ряды металлов и неметаллов
Генетические ряды металлов и неметаллов Косметические средства. Виды, состав и влияние на организм
Косметические средства. Виды, состав и влияние на организм Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания Образование химических связей
Образование химических связей Драгоценные камни
Драгоценные камни Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Кислоты
Кислоты Количество вещества
Количество вещества Сода. Что я знаю о ней!?
Сода. Что я знаю о ней!? Кристаллы. Формирование кристаллов
Кристаллы. Формирование кристаллов Природный каучук
Природный каучук Полимеры. Пластмассы
Полимеры. Пластмассы Общая характеристика VIIА-группы – Галогены
Общая характеристика VIIА-группы – Галогены Никель
Никель Презентация на тему Применение спиртов
Презентация на тему Применение спиртов  Окислительно-восстановительные реакции. Лекция №7
Окислительно-восстановительные реакции. Лекция №7 Предельные одноатомные спирты
Предельные одноатомные спирты Применение кислорода. Что же такое Кислород?
Применение кислорода. Что же такое Кислород? Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Нитраты в продуктах
Нитраты в продуктах Презентация на тему Отравляющие вещества
Презентация на тему Отравляющие вещества  Тест по теме Спирты. Фенол
Тест по теме Спирты. Фенол Аммиак. Соли аммония
Аммиак. Соли аммония кристал решетка
кристал решетка