Содержание
- 2. Основные понятия и определения Химическая термодинамика – это раздел химии, изучающий взаимные превращения различных форм энергии
- 3. Фаза – это часть ТД системы, обладающая одинаковыми физическими и химическими свойствами Химический компонент – это
- 4. Параметры состояния ТД системы – это характеристики ТД системы, которые можно измерить (V, T, P, m
- 5. Внутренняя энергия Внутренняя энергия U - это общий запас энергии колебательного, вращательного, поступательного и т.д. движения
- 6. Первый закон термодинамики •Теплота (Q), полученная ТД системой, расходуется на изменение её внутренней энергии (ΔU) и
- 7. Энтальпия Qp = ΔU + p·ΔV = U2 – U1 + p(V2 – V1) = (U2
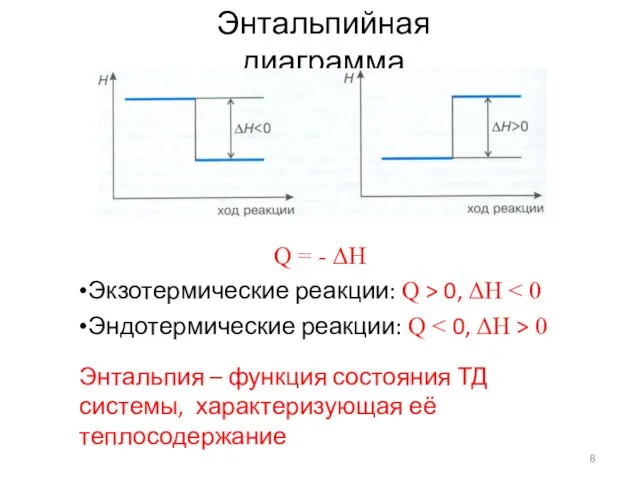
- 8. Энтальпийная диаграмма Q = - ΔH •Экзотермические реакции: Q > 0, ΔH •Эндотермические реакции: Q 0
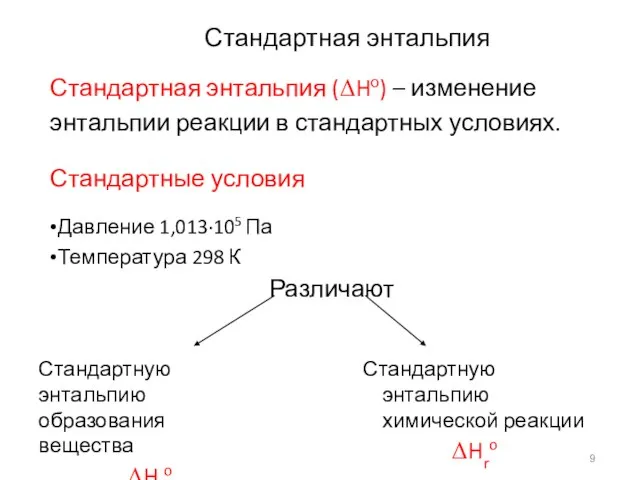
- 9. Стандартная энтальпия Стандартная энтальпия (ΔHо) – изменение энтальпии реакции в стандартных условиях. Стандартные условия •Давление 1,013·105
- 10. Стандартная энтальпия образования вещества ΔHfo – количество теплоты, которое поглощается или выделяется при образовании одного моля
- 11. Термохимические уравнения Н2(г) + 1/2О2(г) = Н2О(г) ; ΔHfo (H2O) = - 241,8 кДж/моль Особенности термохимических
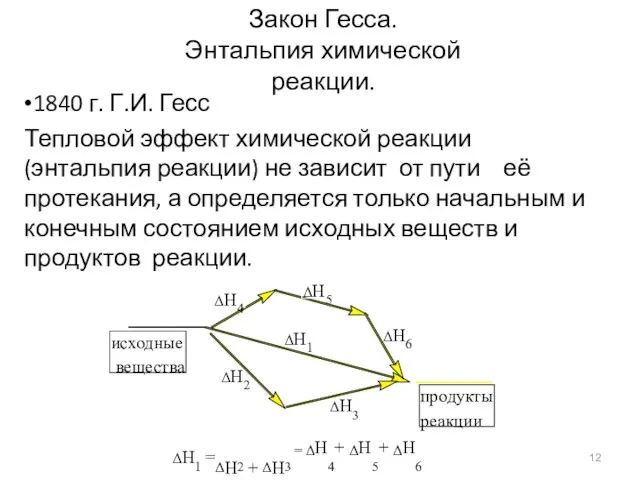
- 12. Закон Гесса. Энтальпия химической реакции. •1840 г. Г.И. Гесс Тепловой эффект химической реакции (энтальпия реакции) не
- 13. Следствия из закона Гесса Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы
- 14. Энтропия. Второй закон термодинамики Энтропия S – это мера беспорядка ТД системы. В изолированной системе энтропия
- 15. Энтропия (S) есть логарифмическое выражение термодинамической вероятности существования системы. S = k⋅lnW, где k - постоянная
- 17. Третий закон термодинамики Энтропия правильного кристалла стремится к 0 по мере приближения температуры к абсолютному 0
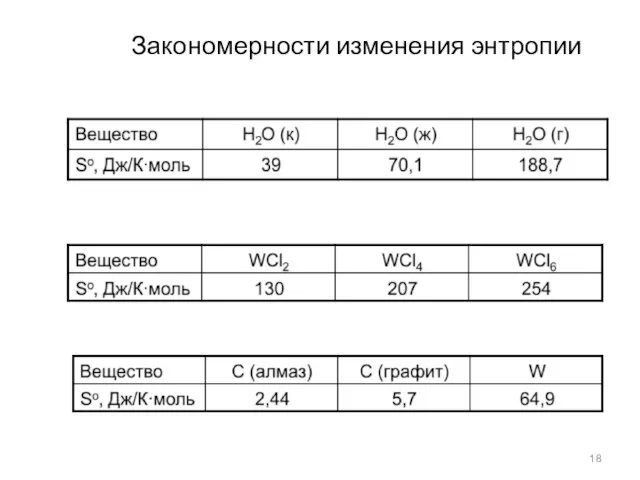
- 18. Закономерности изменения энтропии
- 19. Направление протекания химических процессов. Энергия Гиббса ΔG = ΔH - ТΔS ΔG – энергия Гиббса -
- 20. ΔG > 0 самопроизвольный процесс невозможен, реакция не протекает в прямом направлении, но может протекать в
- 21. Температурная зависимость энергии Гиббса Если ΔH 0, то ΔG Если ΔH > 0 и ΔS 0
- 22. ΔGro – стандартная энергия Гиббса реакции. ΔGfo – стандартная энергия Гиббса образования вещества. Если ΔGfo термодинамически
- 24. Скачать презентацию















 Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Каучук. Строение и применение
Каучук. Строение и применение Классификация кислот
Классификация кислот Ионные уравнения реакций
Ионные уравнения реакций Коды Менделеева
Коды Менделеева Фенол. Физические свойства
Фенол. Физические свойства Тест 1 задание
Тест 1 задание Соли. Свойства. Получение
Соли. Свойства. Получение Презентация на тему Азотная кислота и её соли
Презентация на тему Азотная кислота и её соли  Применение серы
Применение серы рН розчину
рН розчину Тестирование по химии
Тестирование по химии Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7
Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7 Аминокислоты. Викторина
Аминокислоты. Викторина Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот Презентация на тему Альдегиды и их свойства
Презентация на тему Альдегиды и их свойства  Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11) Атом- сложная частица
Атом- сложная частица Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Химия и автомобиль
Химия и автомобиль Строение атома углерода. 10 класс
Строение атома углерода. 10 класс Презентация на тему Основные понятия химии
Презентация на тему Основные понятия химии  Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Гидролиз солей
Гидролиз солей