Содержание
- 2. Химические свойства алкенов Присоединение Полимеризация Окисление Гидрирование Гидратация Галогенирование Гидрогалогенирование Горение Реакция Вагнера Каталитическое окисление
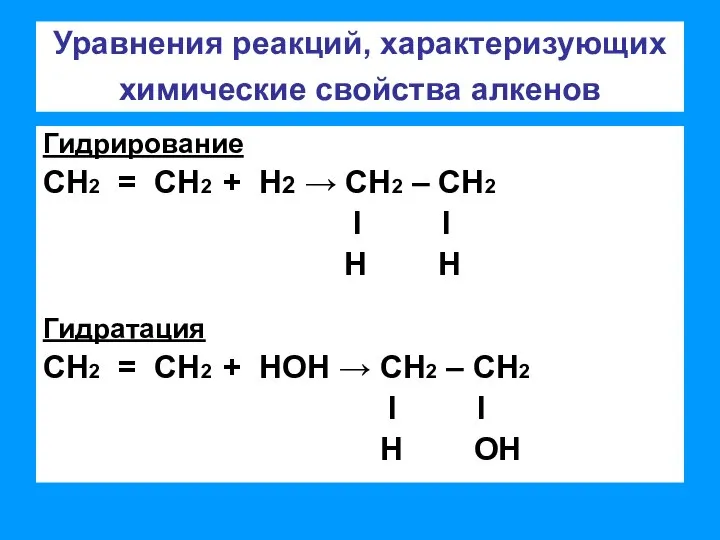
- 3. Уравнения реакций, характеризующих химические свойства алкенов Гидрирование СН2 = СН2 + Н2 → СН2 – СН2
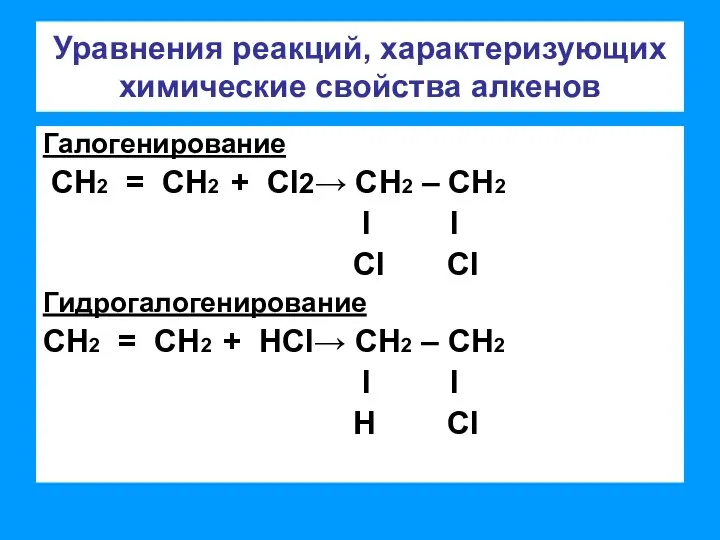
- 4. Уравнения реакций, характеризующих химические свойства алкенов Галогенирование СН2 = СН2 + CI2→ СН2 – СН2 l
- 5. Качественная реакция на непредельные углеводороды (в т.ч. алкены) СН2 = СН2 + Br2 → СН2 –
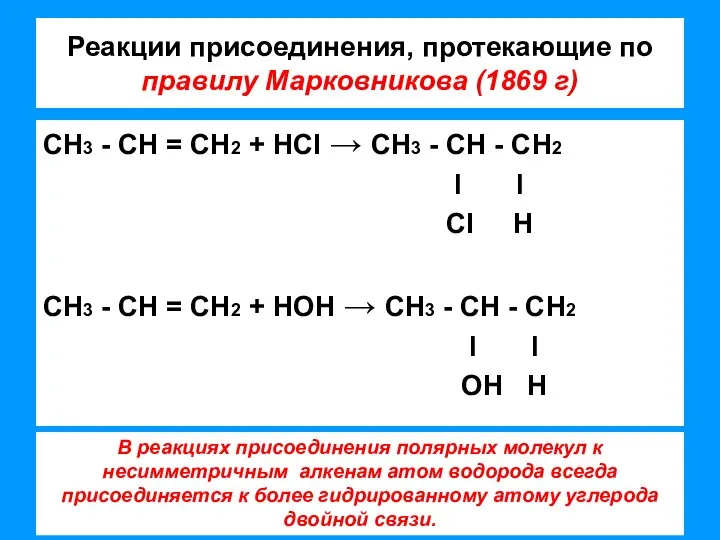
- 6. Реакции присоединения, протекающие по правилу Марковникова (1869 г) СН3 - СН = СН2 + НCI →
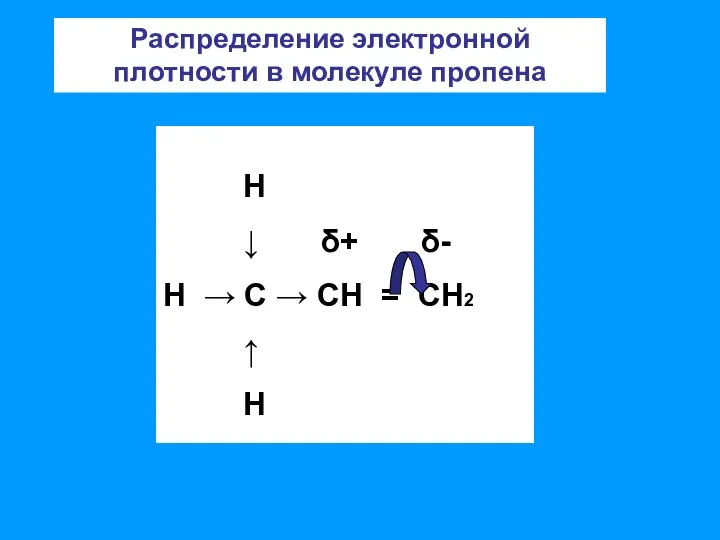
- 7. Н ↓ δ+ δ- Н → С → СН = СН2 ↑ Н Распределение электронной плотности
- 8. Уравнения реакций, характеризующих химические свойства алкенов Реакция полимеризации n(СН2 = СН2) → (- СН2 – СН2
- 9. Уравнения реакций, характеризующих химические свойства алкенов Каталитическое окисление В присутствии хлоридов меди и палладия: 2СН2 =
- 10. Уравнения реакций, характеризующих химические свойства алкенов Окисление Реакция Вагнера СН2 = СН2 + Н2О + KMnO4→
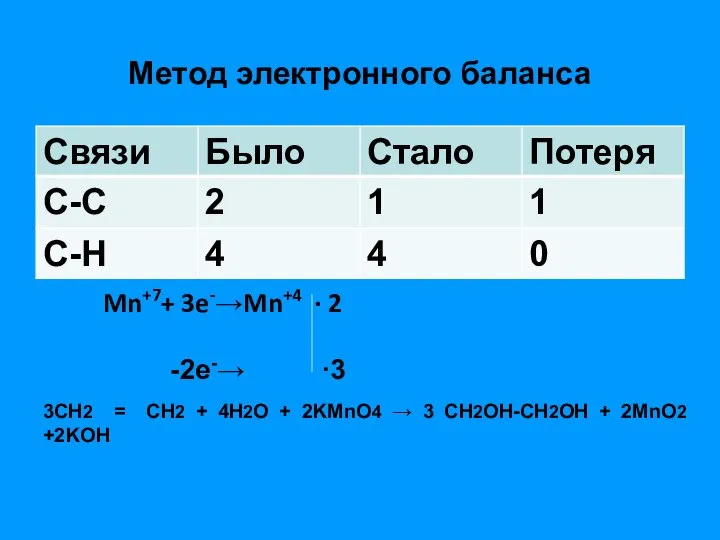
- 11. Метод электронного баланса Mn+7+ 3e-→Mn+4 ∙ 2 -2e-→ ∙3 3СН2 = СН2 + 4Н2О + 2KMnO4
- 12. Окисление алкенов в кислой среде, т.е. в присутствии раствора серной кислоты Окисление в кислой среде Реакция
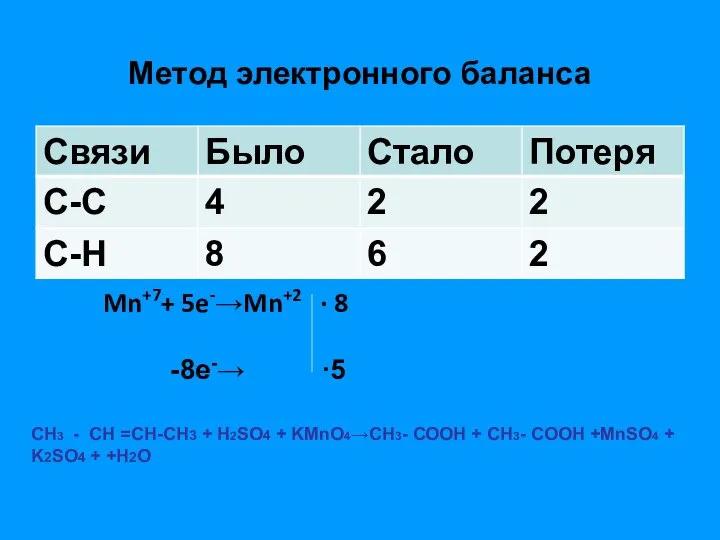
- 13. Метод электронного баланса Mn+7+ 5e-→Mn+2 ∙ 8 -8e-→ ∙5 СН3 - СН =СH-CH3 + Н2SO4 +
- 14. Окисление алкенов в кислой среде, т.е. в присутствии раствора серной кислоты Окисление в кислой среде Реакция
- 15. Окисление алкенов в кислой среде, т.е. в присутствии раствора серной кислоты Окисление в кислой среде Реакция
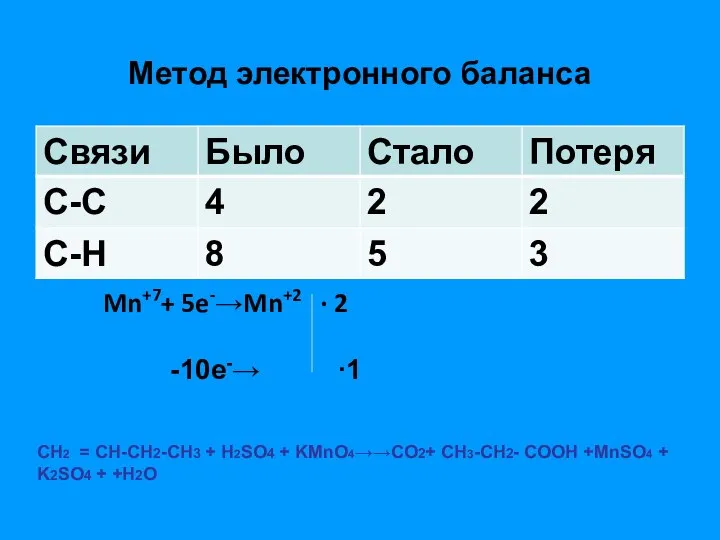
- 16. Метод электронного баланса Mn+7+ 5e-→Mn+2 ∙ 2 -10e-→ ∙1 СН2 = СН-СH2-CH3 + Н2SO4 + KMnO4→→СO2+
- 17. Окисление алкенов в кислой среде, т.е. в присутствии раствора серной кислоты Окисление в кислой среде Реакция
- 18. Окисление алкенов в кислой среде, т.е. в присутствии раствора серной кислоты Окисление в кислой среде Реакция
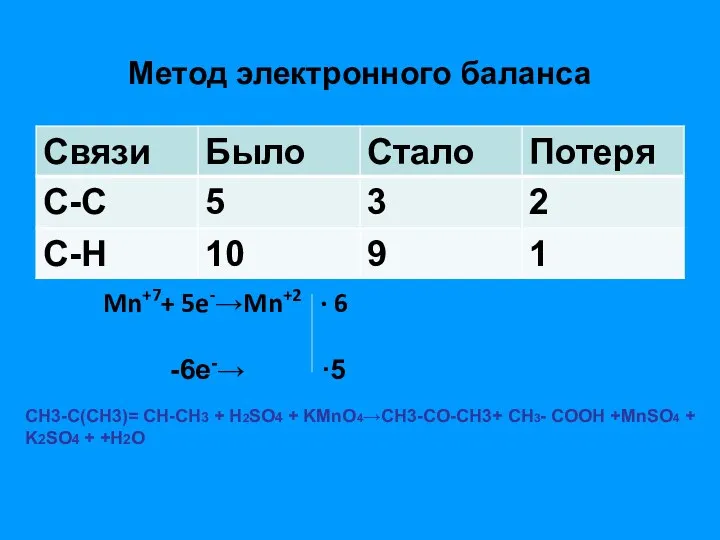
- 19. Метод электронного баланса Mn+7+ 5e-→Mn+2 ∙ 6 -6e-→ ∙5 CH3-С(CH3)= СН-CH3 + Н2SO4 + KMnO4→СH3-CO-CH3+ СН3-
- 21. Скачать презентацию










 Химия вокруг нас. 10 класс
Химия вокруг нас. 10 класс Облик и габитус кристаллов
Облик и габитус кристаллов Гидролиз солей. Лекция №18
Гидролиз солей. Лекция №18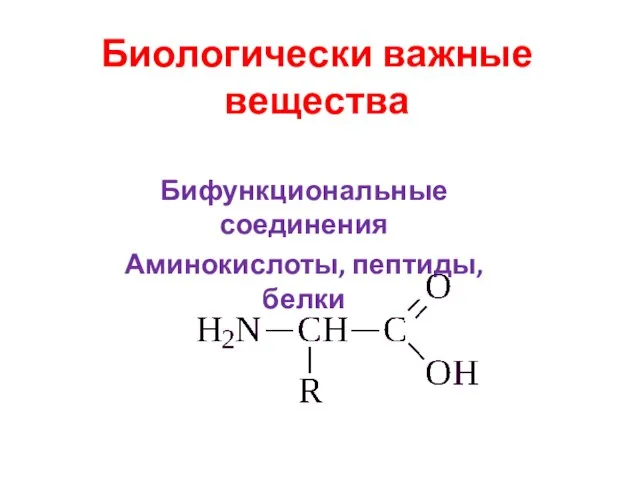 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Л-1-4
Л-1-4 Химия цвета
Химия цвета Дисперсные системы
Дисперсные системы Стеклоткани. Виды стеклотканей
Стеклоткани. Виды стеклотканей Аллотропные модификации углерода
Аллотропные модификации углерода Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов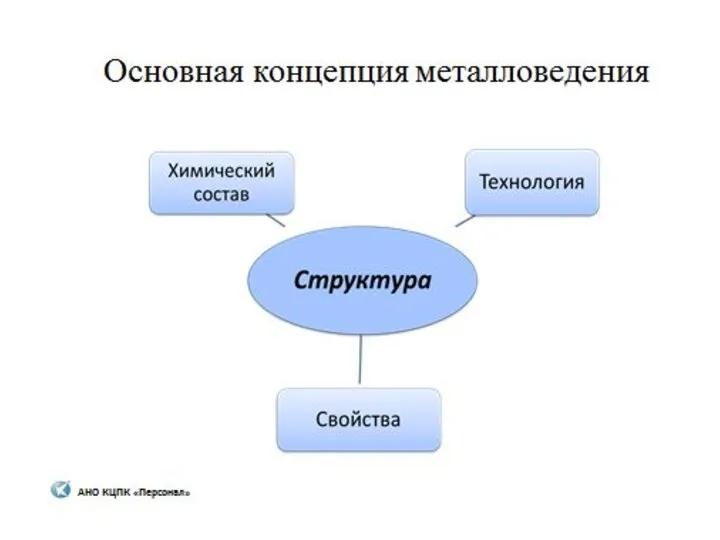 Металловедение
Металловедение Углеводороды
Углеводороды Общая характеристика неметаллов. 9 класс
Общая характеристика неметаллов. 9 класс Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Практико-ориентировочный проект Оксиды на службе у человека
Практико-ориентировочный проект Оксиды на службе у человека Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Спирты (алканолы)
Спирты (алканолы) Ароматерапия
Ароматерапия Начало репликации. Направление движения вилки репликации
Начало репликации. Направление движения вилки репликации Современные подходы к преподаванию химии
Современные подходы к преподаванию химии Синтез-газ
Синтез-газ Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Chemia kosmetyczna
Chemia kosmetyczna Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты. Сложные эфиры. Жиры Казанская химическая школа
Казанская химическая школа Фотографии к исследовательской работе в рамках конкурса УРАЛХИМиЯ
Фотографии к исследовательской работе в рамках конкурса УРАЛХИМиЯ