Содержание
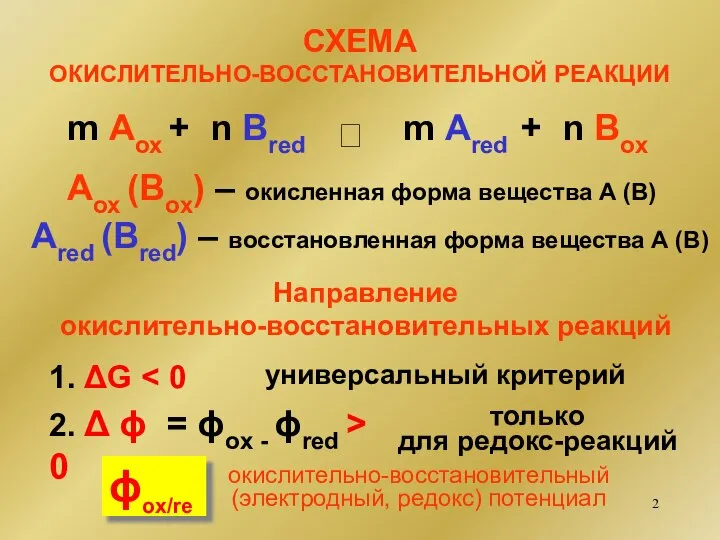
- 2. СХЕМА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ ⮀ m Aox + n Bred m Ared + n Box Aox (Box)
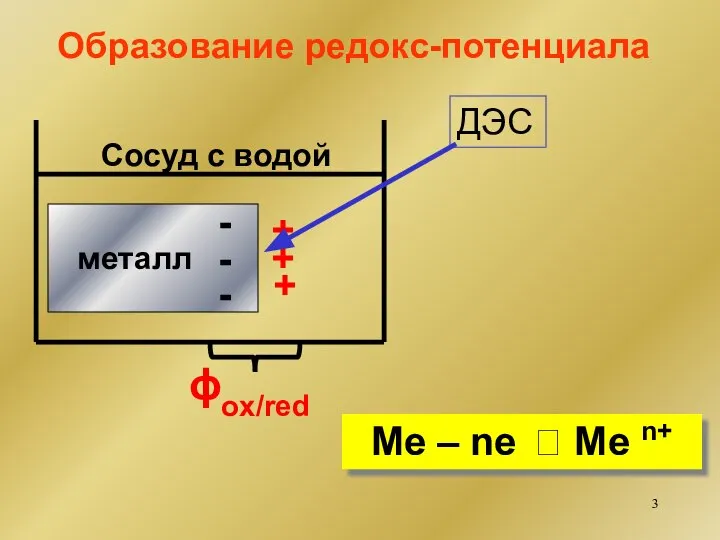
- 3. Образование редокс-потенциала Сосуд с водой + + + Me – ne ⮀ Me n+ ϕox/red металл
- 4. Электродный потенциал ϕox/red – разность электростатических потенциалов между электродом и находящимся с ним в контакте электролитом.
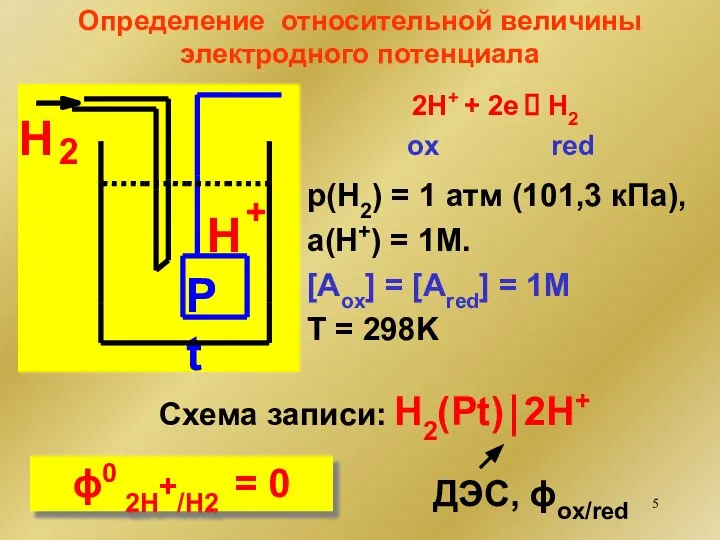
- 5. Определение относительной величины электродного потенциала 2H+ + 2e ⮀ H2 ox red Схема записи: H2(Pt)⏐2H+ ДЭС,
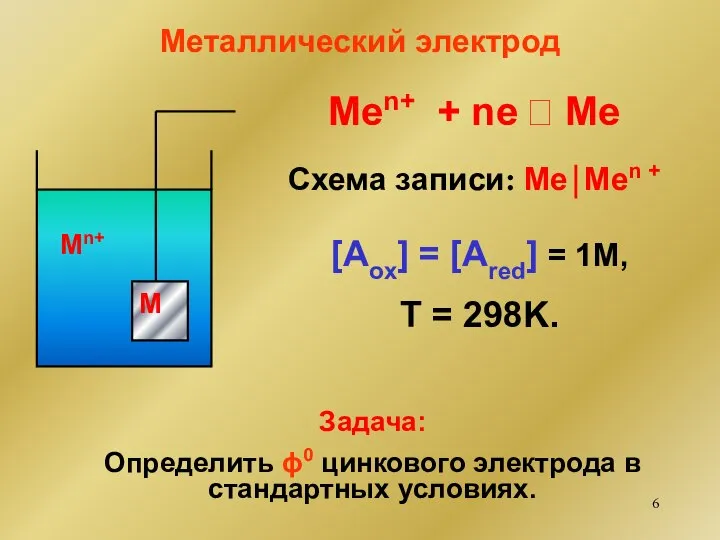
- 6. Металлический электрод Men+ + ne ⮀ Me Схема записи: Me⏐Men + Задача: Определить ϕ0 цинкового электрода
- 7. [Zn+2] =1M Zn – 2e → Zn2+ 2H+ + 2e- → H2 Водородно-цинковый гальванический элемент Процесс
- 8. Схема записи цепи: -анод ⏐ анодный раствор ⏐⏐ катодный раствор ⏐ катод+ Солевой мостик Расчет э.д.с.
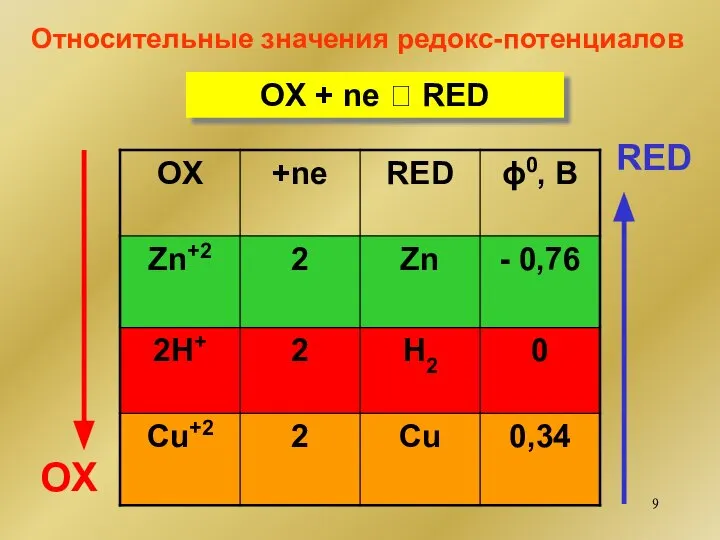
- 9. OX + ne ⮀ RED OX RED Относительные значения редокс-потенциалов
- 10. Ряд напряжений металлов Бекетов Н.Н. (1827-1911)
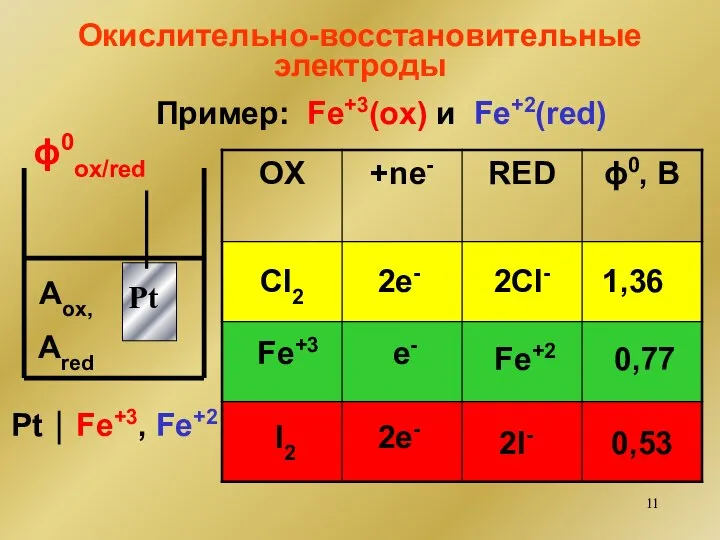
- 11. Окислительно-восстановительные электроды ϕ0ox/red Pt ⏐ Fe+3, Fe+2 Aox, Ared Cl2 Fe+3 I2 2e- e- 2e- 2Cl-
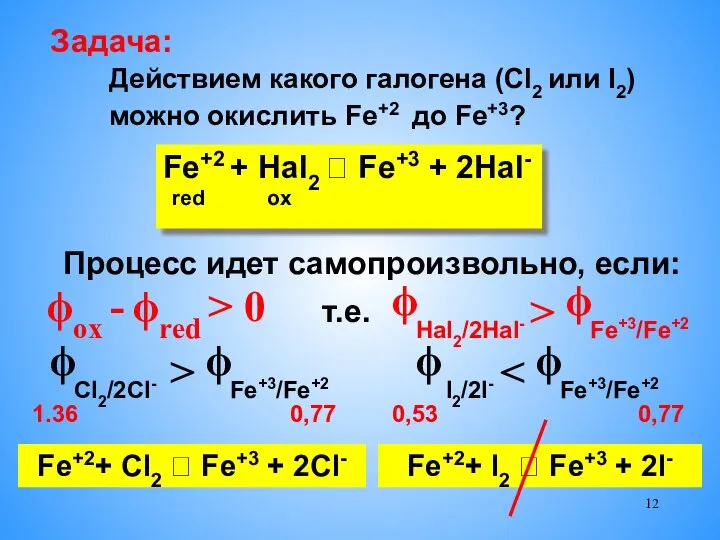
- 12. Действием какого галогена (Cl2 или I2) можно окислить Fe+2 до Fe+3? Процесс идет самопроизвольно, если: ϕox
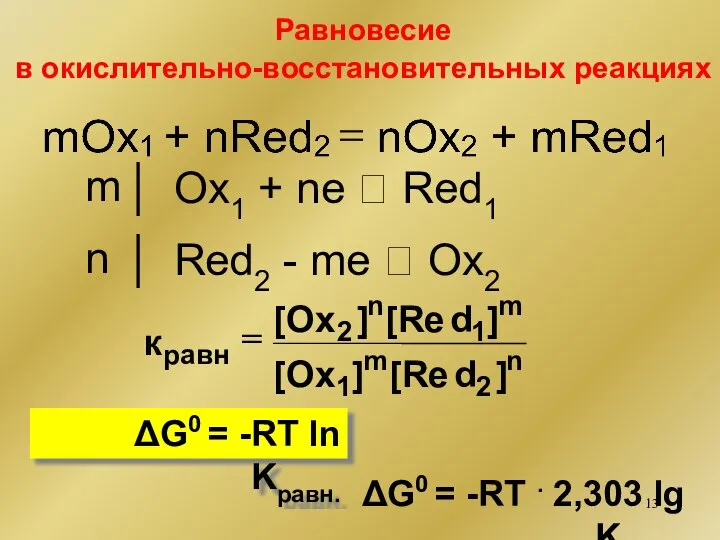
- 13. Равновесие в окислительно-восстановительных реакциях ΔG0 = -RT ln Kравн. ΔG0 = -RT . 2,303 lg Kравн.
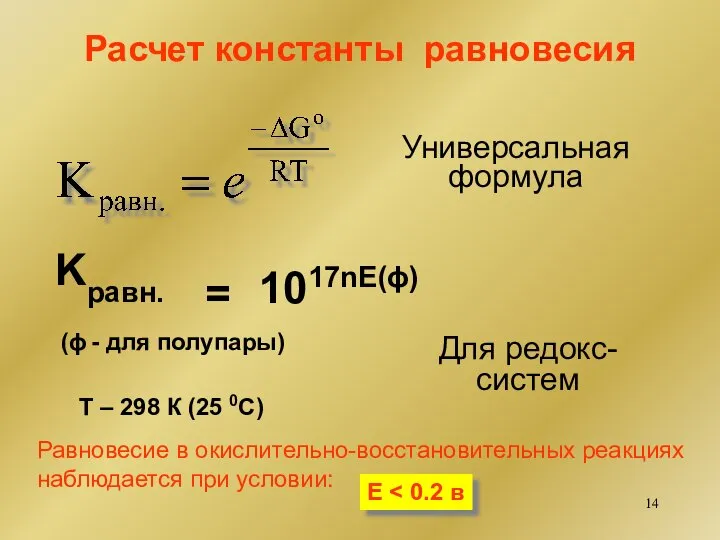
- 14. Расчет константы равновесия Универсальная формула Для редокс- систем Равновесие в окислительно-восстановительных реакциях наблюдается при условии: Е
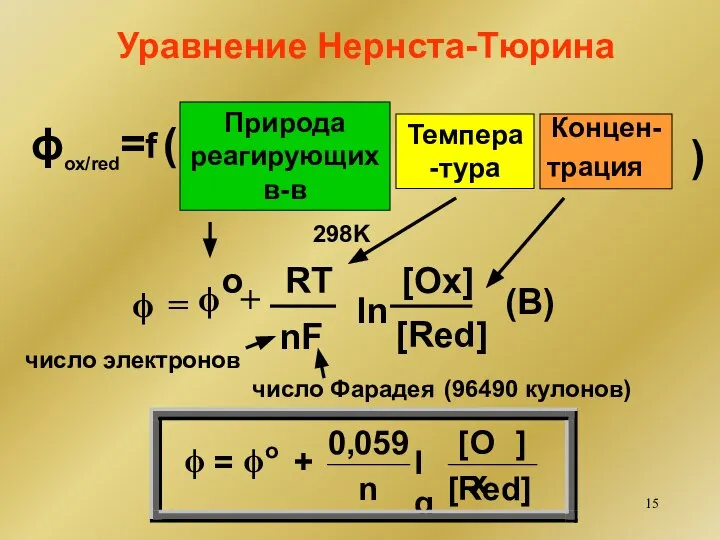
- 15. Уравнение Нернста-Тюрина ) Природа реагирующих в-в ϕox/red= ( Темпера-тура Концен- трация f число электронов число Фарадея
- 16. Зависимость редокс-потенциала от рН среды Ox + ne- + mH+ ⮀ Red + m/2 H2O При
- 17. Потенциалы наиболее распространенных электродов ϕ = - 0,059 рН Водородный электрод ϕ = ϕ0 + lg[Me+n]
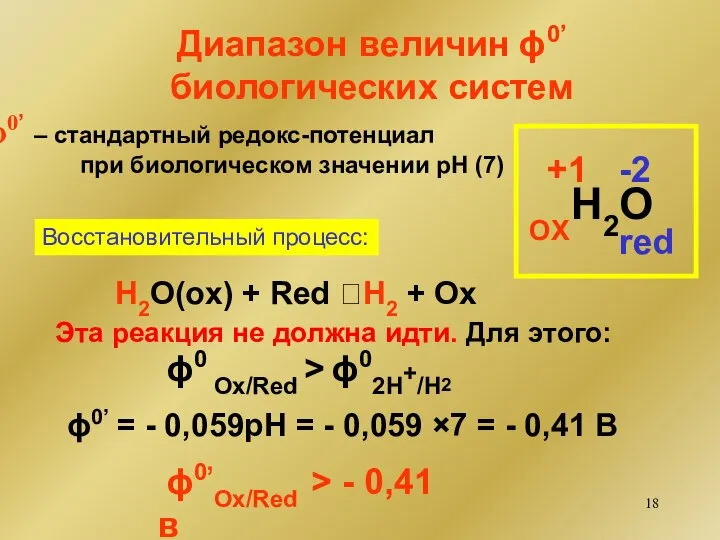
- 18. H2O Диапазон величин ϕ0’ биологических систем 0’ – стандартный редокс-потенциал при биологическом значении рН (7) +1
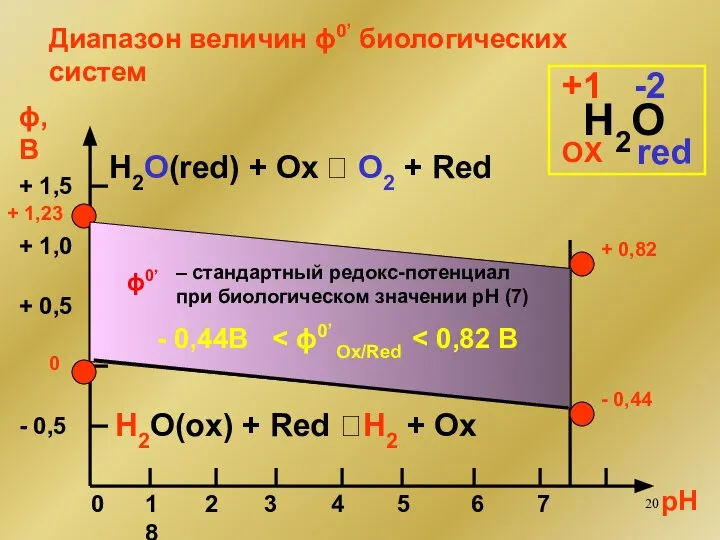
- 19. H2O(red) + Ox ⮀ O2 + Red Эта реакция не должна идти. Для этого: ϕ0 Ox/Red
- 20. ϕ, В 0 рН - 0,5 0 + 0,5 + 1,0 + 1,5 1 2 3
- 22. Скачать презентацию

![[Zn+2] =1M Zn – 2e → Zn2+ 2H+ + 2e- → H2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1183296/slide-6.jpg)





 Дисперсные системы. Лекция №7
Дисперсные системы. Лекция №7 Презентация на тему Аллотропные видоизменения неметаллов
Презентация на тему Аллотропные видоизменения неметаллов  Основные соединения кальция и их применение – вчера, сегодня, завтра.
Основные соединения кальция и их применение – вчера, сегодня, завтра. Модульная технология на уроках химии
Модульная технология на уроках химии Презентация на тему Натуральные волокна
Презентация на тему Натуральные волокна  Харктеристика металлов
Харктеристика металлов Щелочноземельные металлы
Щелочноземельные металлы Гетерогенные дисперсные системы
Гетерогенные дисперсные системы Презентация на тему Синтетические материалы
Презентация на тему Синтетические материалы  Строение сплавов, диаграммы состояний
Строение сплавов, диаграммы состояний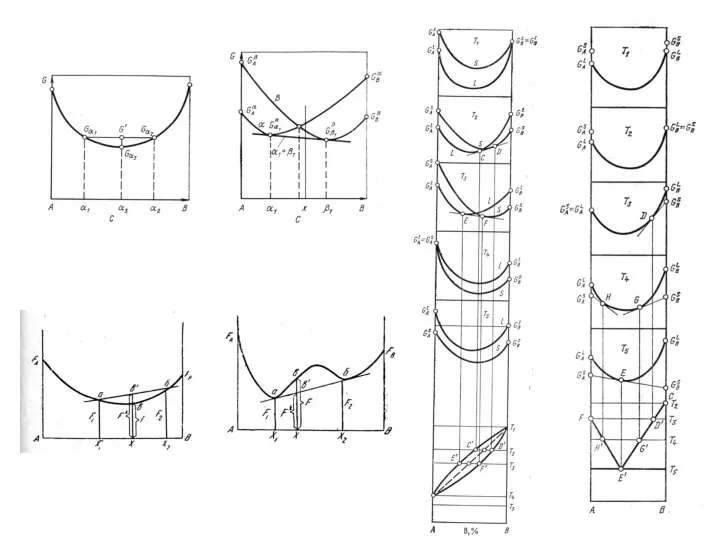 Кинетика кристаллизации сплавов
Кинетика кристаллизации сплавов Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Приобретённые: недостаточность митохондрий,
Приобретённые: недостаточность митохондрий, Кварцевые пески
Кварцевые пески МОУ СОШ №3 г. Хвалынска Саратовской области Тема: Ковалентная полярная связь Учитель химии и биологии Высшей квалификационно
МОУ СОШ №3 г. Хвалынска Саратовской области Тема: Ковалентная полярная связь Учитель химии и биологии Высшей квалификационно Химическая викторина
Химическая викторина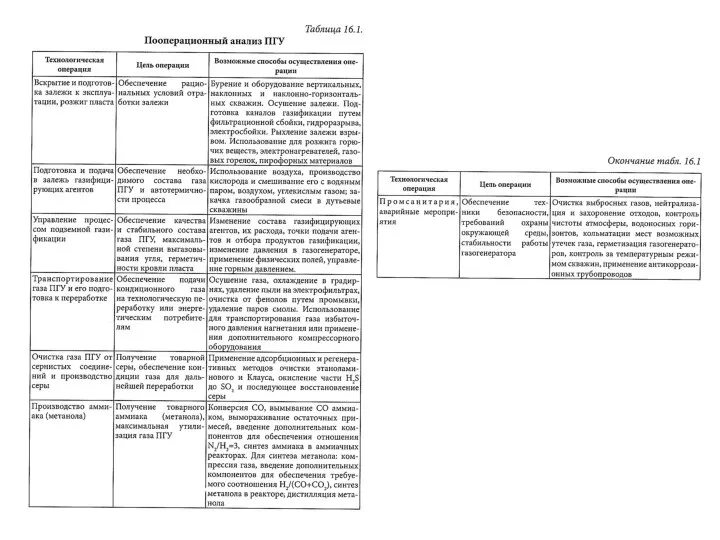 Пооперационный анализ ПГУ
Пооперационный анализ ПГУ Кремний. Технический кремний
Кремний. Технический кремний Химические свойства металлов
Химические свойства металлов Введение в общую теорию поверхностных явлений. Лекция 1
Введение в общую теорию поверхностных явлений. Лекция 1 Физика Доклад
Физика Доклад Типы метаморфизма
Типы метаморфизма Ковалентная связь. Радикалы
Ковалентная связь. Радикалы Срспальфа-олефинсульфанаттар
Срспальфа-олефинсульфанаттар Презентация на тему Полимеразная цепная реакция (ПЦР)
Презентация на тему Полимеразная цепная реакция (ПЦР)  Дисперсные системы в пищевой промышленности
Дисперсные системы в пищевой промышленности Полиуретаны. Структура и строение
Полиуретаны. Структура и строение Межкристаллитная коррозия МКК
Межкристаллитная коррозия МКК