Содержание
- 2. Примерное время выполнения задания – 2 минуты Уровень сложности задания – базовый Максимальный балл за выполнение
- 3. Для выполнения задания необходимо использовать Периодическую систему химических элементов Д. И. Менделеева. На экзамене таблица будет
- 4. Перед выполнением предложенных заданий повторите: Периодический закон гласит: свойства атомов химических элементов, состав и свойства образуемых
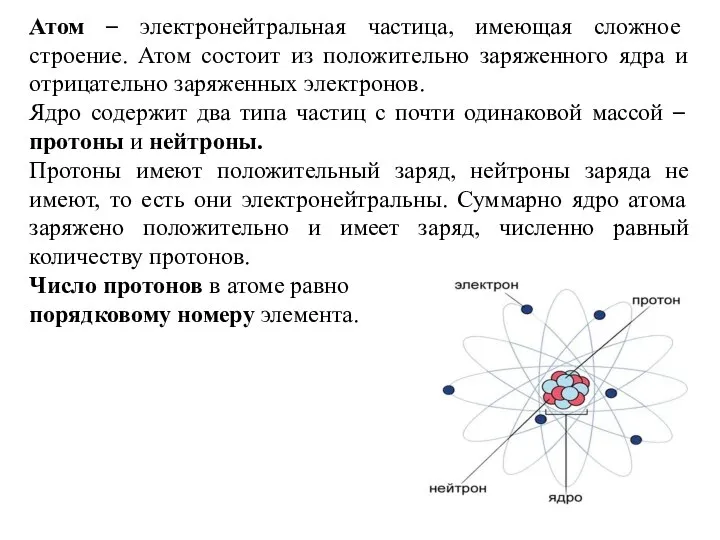
- 5. Атом – электронейтральная частица, имеющая сложное строение. Атом состоит из положительно заряженного ядра и отрицательно заряженных
- 6. В ядре атома одного и того же элемента всегда содержится одинаковое число протонов. А число нейтронов
- 7. Если ядро имеет положительный заряд, то в состав атома должны входить отрицательно заряженные частицы – электроны.
- 8. Орбиталь – область пространства вокруг ядра, в которой с наибольшей вероятностью находится электрон. На одной орбитали
- 9. Условное изображение распределения электронов в электронном облаке по уровням, подуровням и орбиталям называется электронной формулой атома.
- 10. Число электронов на внешнем уровне определяется номером группы. Число энергетических уровней показывает номер периода, в котором
- 11. Обрати внимание! Порядковый номер элемента = заряд ядра атома = число протонов в ядре = число
- 12. Тренировочные задания Задание 1. На приведённом рисунке изображена модель атома химического элемента. Запишите в поле ответа
- 14. Скачать презентацию










 Prezentatsia_Microsoft_PowerPoint (1)
Prezentatsia_Microsoft_PowerPoint (1) Классификация реакций
Классификация реакций Пидорасня
Пидорасня Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Пространственное строение. Стереоизомерия. Структура и функции биолекул
Пространственное строение. Стереоизомерия. Структура и функции биолекул Презентация на тему Щелочноземельные металлы
Презентация на тему Щелочноземельные металлы  Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Карбонильные соединения
Карбонильные соединения Презентация на тему Применение солей в быту
Презентация на тему Применение солей в быту  Окислительно-восстановительные реакции. Лекция №7
Окислительно-восстановительные реакции. Лекция №7 Ароматические соединения. Галогенпроизводные
Ароматические соединения. Галогенпроизводные Классы неорганических веществ
Классы неорганических веществ Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Презентация Лекция 2. Химическая кинетика
Презентация Лекция 2. Химическая кинетика Презентация на тему: Подгруппа азота
Презентация на тему: Подгруппа азота Презентация на тему Биотехнологии. Генная инженерия
Презентация на тему Биотехнологии. Генная инженерия  Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Презентация на тему Химические свойства многоатомных спиртов
Презентация на тему Химические свойства многоатомных спиртов  Современные сплавы на основе циркония
Современные сплавы на основе циркония Жиры
Жиры Относительная молекулярная масса вещества
Относительная молекулярная масса вещества Пайданалылған майларды қолдана отырып көмірді брикеттер алу
Пайданалылған майларды қолдана отырып көмірді брикеттер алу Соли Na2SO4
Соли Na2SO4 Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение