Содержание
- 2. План Общая формула и определение Нахождение в природе 3. Физические свойства 4. Получение 5. Химические свойства
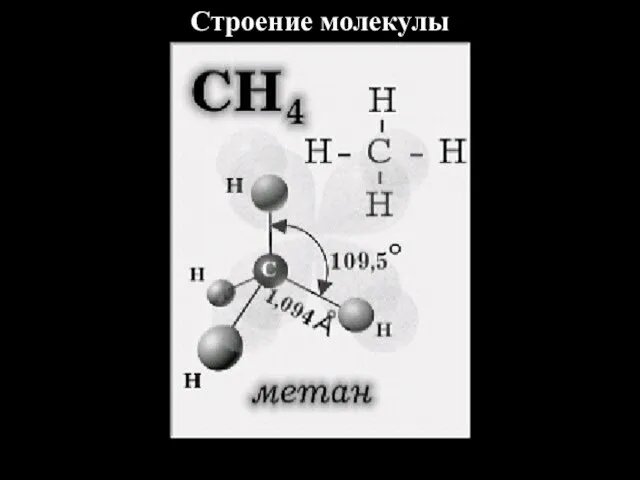
- 3. Строение алканов Алканы – углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных друг с
- 4. Строение молекулы
- 5. Нахождение в природе Метан – образуется в природе в результате разложения остатков растений и животных без
- 6. Физические свойства С1 – С4 – ГАЗЫ, С5-С10 – ЖИДКОСТИ, С10 ……-ТВЕРДЫЕ.
- 7. Получение Из природного сырья (нефть, газ) – перегонка Крекинг нефтепродуктов C16H34 C8H18 + C8H16 C8H18 C4H10
- 8. Химические свойства 1.Замещение: CH4 + Cl2 свет CH3Cl + HCl CH3Cl + Cl2 свет CH2Cl2 +
- 9. Химические свойства 3. Отщепление CH3 – CH3 Pt,t0 CH2 = CH2 + H2 CH3 – CH2
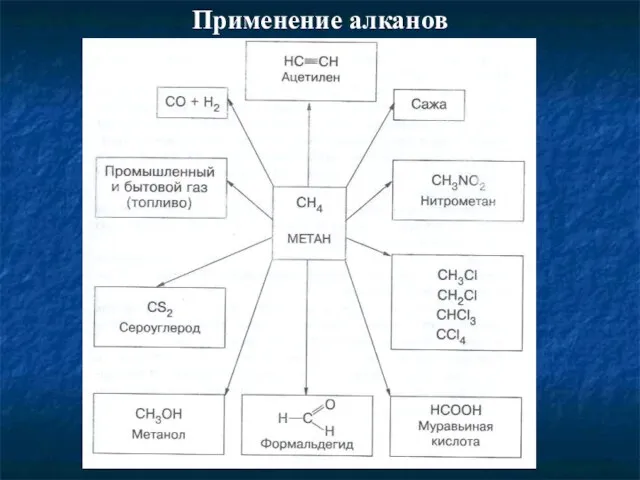
- 10. Применение алканов
- 12. Скачать презентацию







 Контрольная работа №1
Контрольная работа №1 Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Пластмассы. Классификация
Пластмассы. Классификация Кислоты
Кислоты Щелочные металлы
Щелочные металлы Ароматические углеводороды
Ароматические углеводороды Презентация на тему Показатели воды - её жесткость и кислотность
Презентация на тему Показатели воды - её жесткость и кислотность  Кетоны. Формулы кетонов
Кетоны. Формулы кетонов Химия и косметика
Химия и косметика Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна
Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна Физическая химия растворов электролитов
Физическая химия растворов электролитов Презентация на тему Кальций
Презентация на тему Кальций  Менделеевский период
Менделеевский период Молярный объем газов
Молярный объем газов Классификация неорганический веществ
Классификация неорганический веществ Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А.
Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А. Хлор
Хлор Простые вещества - неметаллы
Простые вещества - неметаллы Кислоты. 3 класс
Кислоты. 3 класс Периодическая система химических элементов. Периоды. Группы
Периодическая система химических элементов. Периоды. Группы Процесс электролиза
Процесс электролиза химия
химия Гальванические элементы
Гальванические элементы Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11) Основные понятия химической термодинамики
Основные понятия химической термодинамики Study of short peptide adsorption on solution dispersed. Inorganic nanoparticles using depletion method
Study of short peptide adsorption on solution dispersed. Inorganic nanoparticles using depletion method Этиленовые углеводороды (алкены, олефины)
Этиленовые углеводороды (алкены, олефины) Хроматография. Особенности метода хроматографии
Хроматография. Особенности метода хроматографии