Содержание
- 2. Kp1000 = exp(+3160 / 8,31 · 1000) = ехр(0,38) = 1,46. При 298 К – Кр
- 3. С увеличением температуры выход продуктов увеличивается Т. к. с увеличением температуры Кр увеличивается, то как следует
- 4. Пример2. Для реакции: А(г) 2В(г) (Р,Т – const) при 400 К - Кр = 0,02 ,
- 5. x – 400y = – 8,31 · 400 ln 0,022 x – 600y = – 8,31
- 6. Пример 3. Решение. Кр = рСО2, Считаем, что ∆rH0 и ∆rS0 от Т не зависят: ∆rG0Т
- 7. ∆rS0298 = S0298,CаО+ S0298,СО2 - S0298,СаСО3 = 160,5 Дж/К 178,1 · 103 – 990 · 160,5=
- 8. Пример 4. Решение. Определить равновесный состав системы при Т = 1000 К , Робщ = 2
- 9. х = 1,7 моль при равновесии: n(СО2) = 5 – x = 5 – 1,7 =
- 10. Пример 5. Решение. Определить Сравновесные СО2 и СО для реакции С(к) + СО2(г) 2СО(г) при Т
- 11. Кс = = 0,018. х = 0,0387моль/л ССО равн = 2 · 0,0387 = 0,0774моль/л ССО2равн
- 13. Скачать презентацию










 Строение вещества
Строение вещества Расстворение. Расстворы
Расстворение. Расстворы Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям 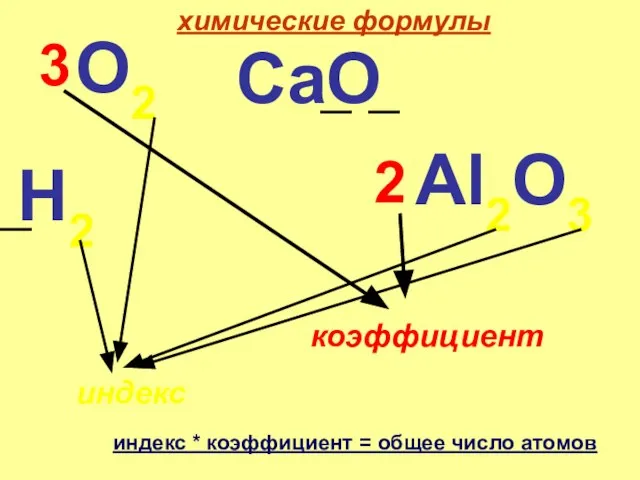 Химические формулы CaO
Химические формулы CaO Амины. Аминокислоты. Белки
Амины. Аминокислоты. Белки Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12
Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12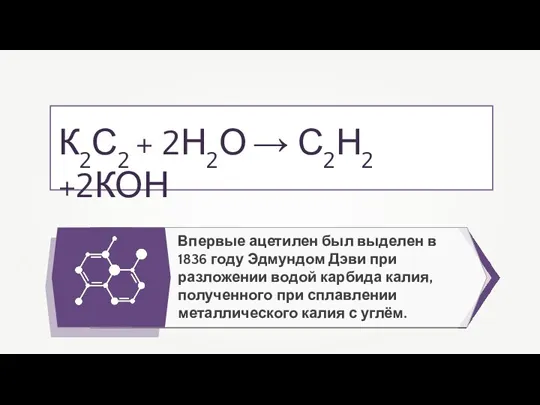 Физические и химические свойства алкинов
Физические и химические свойства алкинов Комісія хімічних дисциплін
Комісія хімічних дисциплін Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Презентация на тему Химия и проблемы экологии. Кислотные дожди
Презентация на тему Химия и проблемы экологии. Кислотные дожди  Строение и свойства предельных и непредельных углеводородов. . Обобщающий урок по химии 10 класс
Строение и свойства предельных и непредельных углеводородов. . Обобщающий урок по химии 10 класс Предмет органической химии
Предмет органической химии Квантовая химия
Квантовая химия Сходство химического состава клеток разных организмов как доказательство их родства
Сходство химического состава клеток разных организмов как доказательство их родства Поляризуемость. Эллипсоид поляризуемости и симметрия молекулы
Поляризуемость. Эллипсоид поляризуемости и симметрия молекулы Масляная кислота
Масляная кислота Ұнтақтар - дәрілік түр ретінде
Ұнтақтар - дәрілік түр ретінде тэд — без анимации(1)
тэд — без анимации(1) Этанол. Химические свойства этанола
Этанол. Химические свойства этанола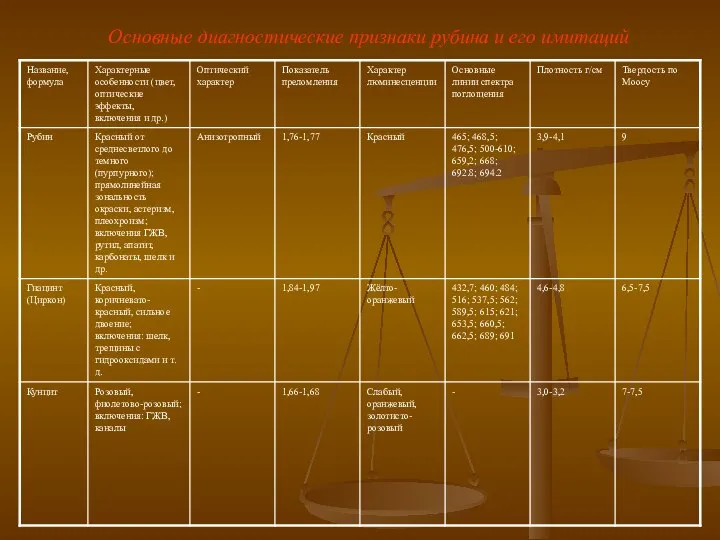 Основные диагностические признаки рубина и его имитаций
Основные диагностические признаки рубина и его имитаций Технология получения полиуретанов
Технология получения полиуретанов Удивительное рядом
Удивительное рядом Турнир знатоков. Интеллектуальная игра
Турнир знатоков. Интеллектуальная игра Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Пероксид водорода
Пероксид водорода