Содержание
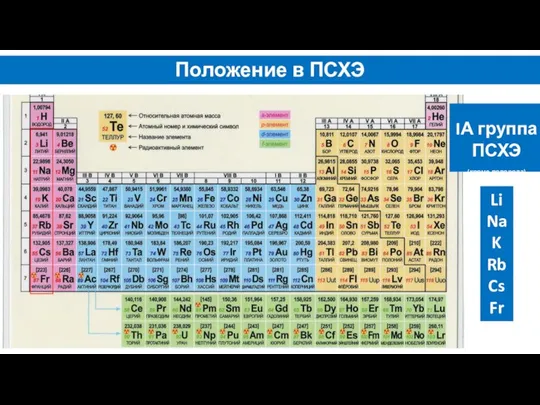
- 2. Положение в ПСХЭ IА группа ПСХЭ (кроме водорода) Li Na K Rb Cs Fr
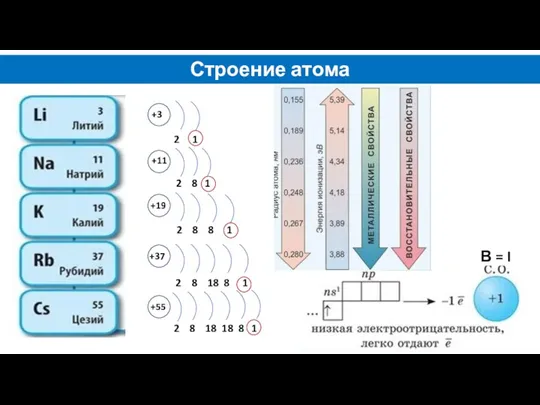
- 3. Строение атома +3 +11 +19 +37 +55 В = I 2 1 2 8 1 2
- 4. Щелочные металлы в природе (только в виде соединений)
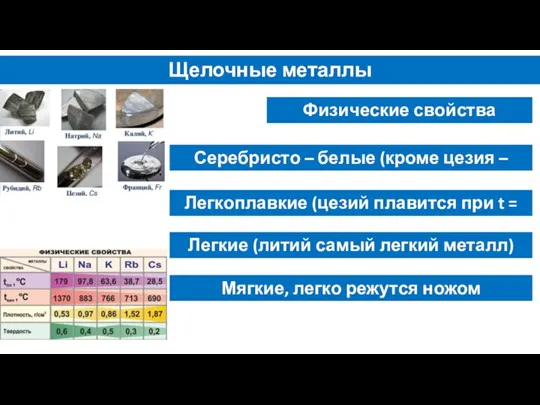
- 5. Щелочные металлы Серебристо – белые (кроме цезия – желтый) Легкоплавкие (цезий плавится при t = 290С)
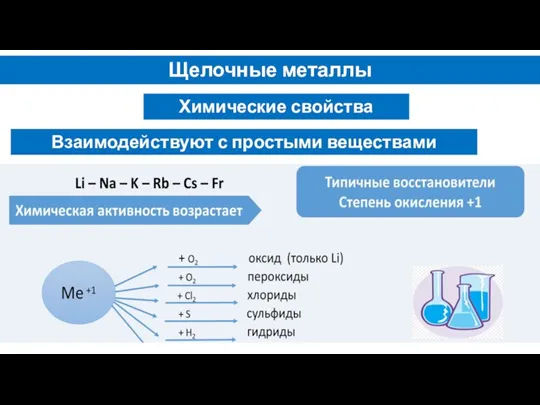
- 6. Щелочные металлы Химические свойства Взаимодействуют с простыми веществами
- 7. Щелочные металлы 4Li + O2 = 2Li2O 2Na + O2 = Na2O2 2Na + Cl2 =
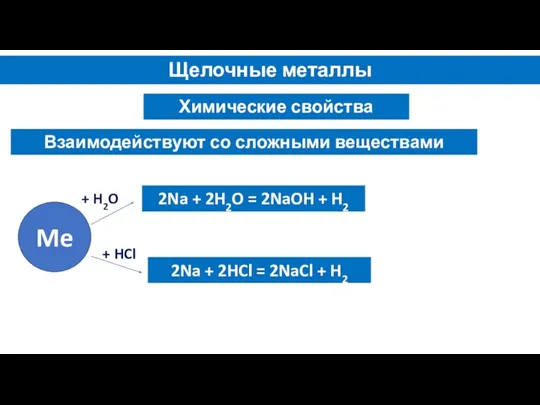
- 8. Щелочные металлы Химические свойства Взаимодействуют со сложными веществами Me + H2O + HCl 2Na + 2H2O
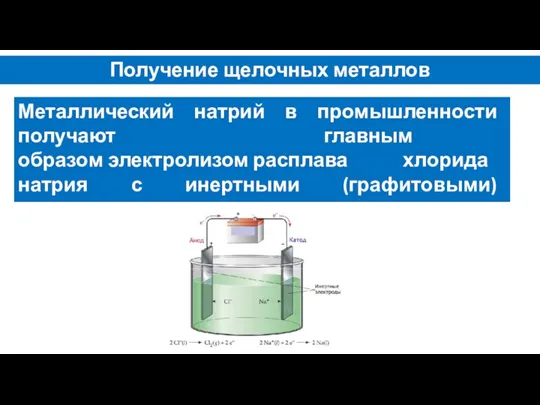
- 9. Получение щелочных металлов Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными
- 10. Качественный анализ катионы щелочных металлов окрашивают пламя в характерные цвета Соли лития придают пламени карминово-красный цвет,
- 12. Скачать презентацию



 Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11) Кислород O2
Кислород O2 Презентация на тему Электролитическая диссоциация
Презентация на тему Электролитическая диссоциация  Презентация на тему Коррозия
Презентация на тему Коррозия  Вода-растворитель. Растворы
Вода-растворитель. Растворы Химический диктант по органической химии. 9 класс
Химический диктант по органической химии. 9 класс Електролітична дисоціація
Електролітична дисоціація Тест-методы анализа объектов окружающей среды
Тест-методы анализа объектов окружающей среды Углерод и его соединения
Углерод и его соединения Плотность веществ. Задачи
Плотность веществ. Задачи Химическая технология. Структура ВКР
Химическая технология. Структура ВКР Презентация на тему Молярный объем
Презентация на тему Молярный объем  Углеводороды: соединения, состоящие из углерода и водорода
Углеводороды: соединения, состоящие из углерода и водорода Химическая связь. Урок-упражнение
Химическая связь. Урок-упражнение Присоединение аммиака и аминов
Присоединение аммиака и аминов Физическая химия. Вводная лекция
Физическая химия. Вводная лекция Повторение по теме Химические реакции
Повторение по теме Химические реакции Степень окисления в соединениях
Степень окисления в соединениях Многоатомные спирты
Многоатомные спирты Химия спирты одноатомные предельные
Химия спирты одноатомные предельные Պոլիմերներ
Պոլիմերներ Исследовательский проект по химии на тему: Жесткость воды и способы ее устранения
Исследовательский проект по химии на тему: Жесткость воды и способы ее устранения Технологические процессы получения кислорода
Технологические процессы получения кислорода Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6
Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6 Ковалентная полярная связь
Ковалентная полярная связь Основные химические понятия и законы химии. (Часть 1)
Основные химические понятия и законы химии. (Часть 1) Методы разделения и очистки веществ
Методы разделения и очистки веществ Строение вещества
Строение вещества