Содержание
- 2. Цель урока: Изучить химическую и электрохимическую коррозию как окислительно - восстановительные процессы, рассмотреть причины возникновения коррозии,
- 3. 1. Понятие коррозии 2. Причины возникновения коррозии 3. Виды коррозии а) химическая б) электрохимическая 4. Способы
- 4. Коррозия (от лат. Corrodere - разъедать) – самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды
- 5. Причины возникновения коррозии Химические и электрохимические процессы окисления, происходящие на поверхности металлических тел при их взаимодействии
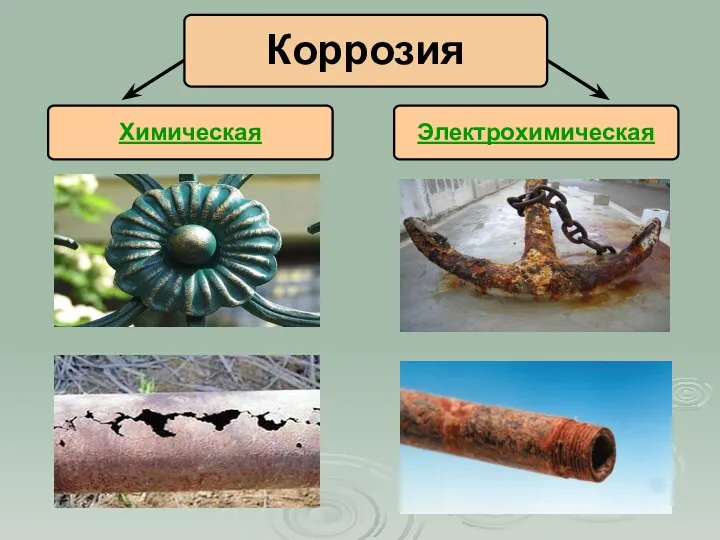
- 6. Электрохимическая Коррозия Химическая
- 7. Химическая коррозия Разрушение металлов и сплавов в результате их химического взаимодействия с веществами окружающей среды (сухие
- 8. Электрохимическая коррозия Разрушение металлов в среде электролита с возникновением внутри системы электрического тока (при контакте двух
- 9. Скорость коррозии больше, чем дальше друг от друга расположены металлы в электрохимическом ряду напряжений металлов: более
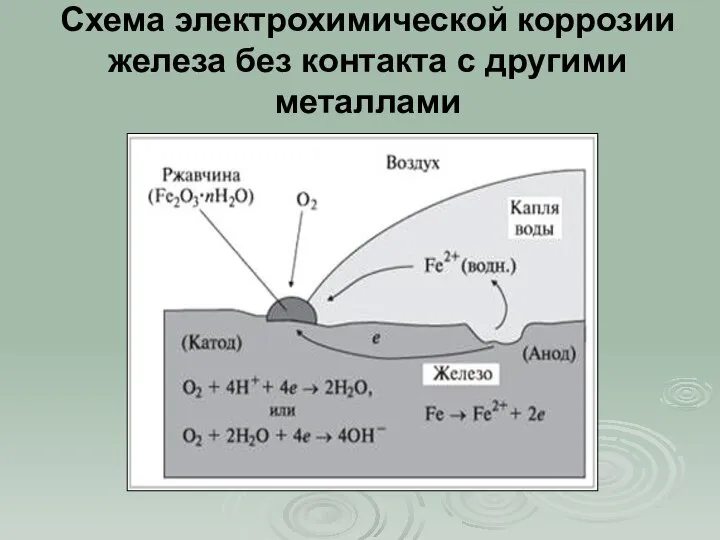
- 10. Схема электрохимической коррозии железа без контакта с другими металлами
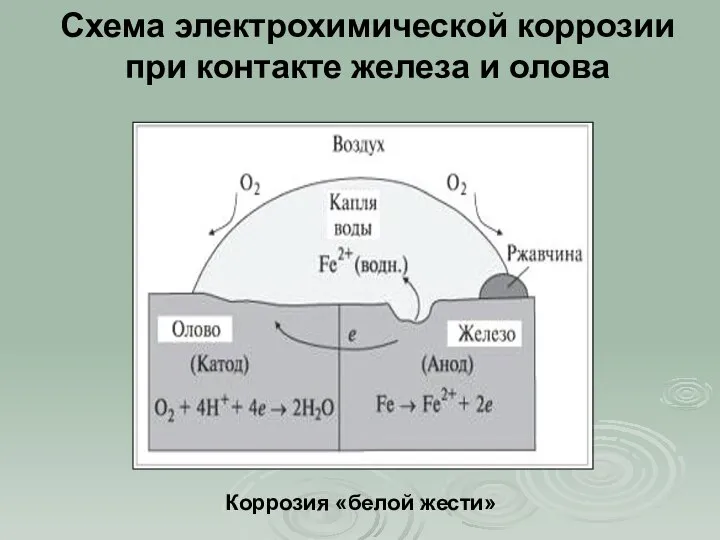
- 11. Схема электрохимической коррозии при контакте железа и олова Коррозия «белой жести»
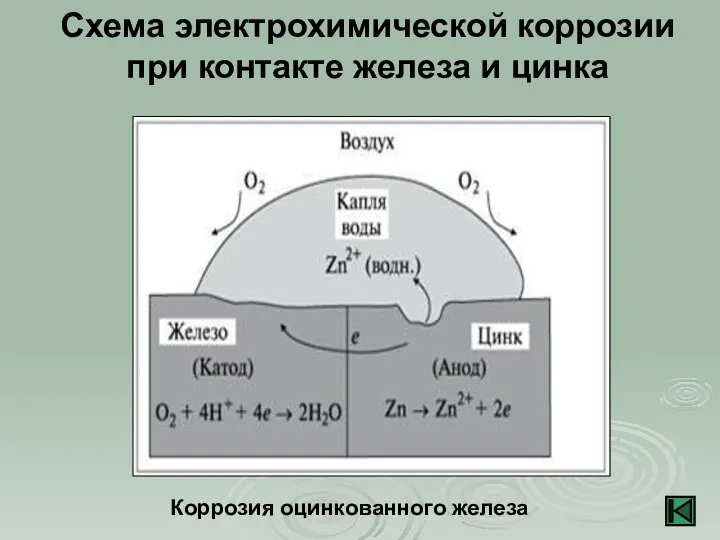
- 12. Схема электрохимической коррозии при контакте железа и цинка Коррозия оцинкованного железа
- 13. Способы защиты от коррозии
- 14. Эйфелева башня Каждые 7 лет Эйфелеву башню, в целях защиты от коррозии, требуется заново красить. На
- 16. Памятник Ю. А. Гагарину Памятник Ю. А. Гагарину облицован пластинками из титанового сплава, не подвергающегося коррозии
- 17. Ингибиторы – вещества, замедляющие или предотвращающие коррозию. Ингибиторы коррозии вводят в замкнутые системы охлаждения, в нефтепродукты,
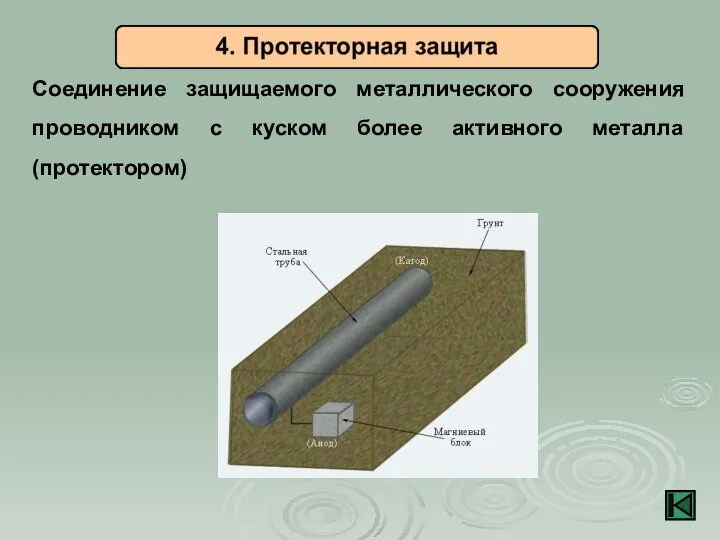
- 18. Соединение защищаемого металлического сооружения проводником с куском более активного металла (протектором)
- 19. Последствия коррозии 1. Материальные потери; 2. Уменьшение надежности работы оборудования; 3.Простой производства из-за замены вышедшего из
- 20. Творческие задачи 1. Скульптуры из бронзы создавались еще в глубокой древности. В XIX веке для отливки
- 21. 2. Почему поверхность статуи, отлитой из бронзы, содержащей даже незначительное количество цинка, со временем покрывается белыми
- 22. 4. В III до нашей эры на острове Родос был построен маяк в виде огромной статуи
- 24. Скачать презентацию
















 Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Презентация на тему Химический состав растений
Презентация на тему Химический состав растений  Оксиды, получение и свойства
Оксиды, получение и свойства Химическое равновесие
Химическое равновесие Ионы. Ионная связь.
Ионы. Ионная связь. Изготовление сложнопрофильных изделий из нитрида кремния
Изготовление сложнопрофильных изделий из нитрида кремния Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия
Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия Решение задач с учетом примесей в веществе
Решение задач с учетом примесей в веществе Железо в продуктах питания
Железо в продуктах питания صيغ المركبات وأسمائها
صيغ المركبات وأسمائها Физические свойства металлов
Физические свойства металлов Алкены-2 (электрофильные реакции)
Алкены-2 (электрофильные реакции) Дисперсные системы
Дисперсные системы Основания, их классификация и свойства
Основания, их классификация и свойства Получение и применение алкенов
Получение и применение алкенов Азот. Физические свойства азота
Азот. Физические свойства азота Морфологія та походження мінералів. Елементи кристалографії
Морфологія та походження мінералів. Елементи кристалографії Изомерия аминокислот
Изомерия аминокислот Физический этап развития периодического закона
Физический этап развития периодического закона Презентация на тему Химические свойства металлов
Презентация на тему Химические свойства металлов  Скорость химических реакций
Скорость химических реакций Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Кислоты и соли
Кислоты и соли Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Химические свойства солей
Химические свойства солей Фосфор, строение, свойства
Фосфор, строение, свойства Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич
Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич Анализ саморазряда элементов литий-дисульфид железа
Анализ саморазряда элементов литий-дисульфид железа