Содержание
- 2. Где и когда впервые было изобретено стекло, достоверно неизвестно. Древнейшие найденные изделия с использованием этого материала
- 3. Комиссия по терминологии АН РФ дала такое определение стеклу: "Стеклом называются все аморфные тела, получаемые путем
- 4. Все вещества, находящиеся в стеклообразном состоянии обладают несколькими общими физико-химическими характеристиками. Типичные стеклообразные тела: 1. изотропны,
- 5. Плотность обычных силикатных стекол, колеблется в приделах 2500-2600 кг/м3. При повышении температуры от 20 до 1300оС
- 6. Неорганические стекла подразделяются на несколько типов: элементарные, оксидные, галогенидные, халькогенидные и смешанные. Элементарные (одноатомные) стекла. Элементарными
- 7. При определеии класса учитывается природа стеклообразующего оксида, входящего в состав стекла оксид бора, оксид кремния, оксид
- 8. Главнейшее значение в практике принадлежит классу силикатных стекол. С ними не могут сравниться по распространенности в
- 9. Стеклообразный борный ангидрит легко получается путем простого плавления борной кислоты при 1200-1300оС. Благодаря отличным электроизоляционным качествам
- 10. на основе органических полимеров: поликрилатов, полистирола, поликарбонатов, сополимеров винилхлорида в соединении с метилметакрилатом. Легко поддается механической
- 11. содержит не менее 99% SiO- (кварца). Кварцевое стекло выплавляют при температуре более 1700° С из самых
- 12. смесь силикатов натрия и калия (или только натрия), водные растворы которых называются жидким стеклом. Растворимое стекло
- 13. искусственное волокно широко применяется в химической промышленности для фильтрации горячих кислых и щелочных растворов, очистки горячего
- 14. Ванная печь непрерывного действия. Конструктивно печь имеет варочный и выработочный бассейн, соединенные между собой по стекломассе
- 15. Стекло занимает большое место среди строительных материалов, на сегодняшний день в архитектуре имеются здания в которых
- 17. Скачать презентацию














 Валентность
Валентность Аналитическая химия. Введение
Аналитическая химия. Введение Молекулярная струйная печать
Молекулярная струйная печать gidroliz_soley (1)
gidroliz_soley (1) Калифорний Cf
Калифорний Cf Железо
Железо Металлы
Металлы Круговорот азота
Круговорот азота Жиры. Классификация
Жиры. Классификация Получение и химические свойства металлов
Получение и химические свойства металлов Оксиды. Классификация оксидов
Оксиды. Классификация оксидов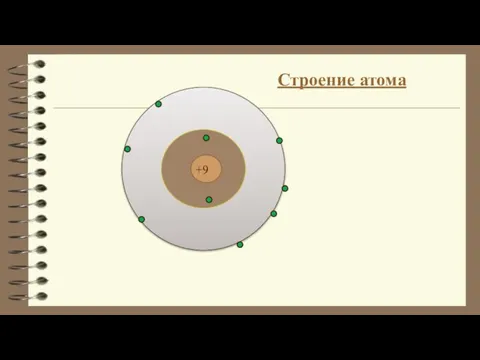 Строение атома
Строение атома Нефть
Нефть Квантовая химия
Квантовая химия Явление когда один элемент образует несколько простых веществ - аллотропия
Явление когда один элемент образует несколько простых веществ - аллотропия Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Классификация реакций
Классификация реакций Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Особенности строения вещества. Лекция №2. Строение кристаллов
Особенности строения вещества. Лекция №2. Строение кристаллов Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Хром. Месторождения
Хром. Месторождения Получение аминов
Получение аминов Классификация неорганических соединений
Классификация неорганических соединений Новое в ЕГЭ. Химия
Новое в ЕГЭ. Химия Получение этилового спирта из древесины
Получение этилового спирта из древесины Металлы. Физические свойства металлов
Металлы. Физические свойства металлов