Содержание
- 2. Лекция 23 Общая характеристика d-элементов Общая электронная формула: […] (n–1)d1-10 ns0-2 IIБ IБ […](n–1)d10ns1 Cr [Ar]3d54s1;
- 3. Лекция 23 Общая характеристика d-элементов Лантаноидное сжатие Радиусы атомов Радиусы 5d- и 6d-элементов очень близки, поэтому
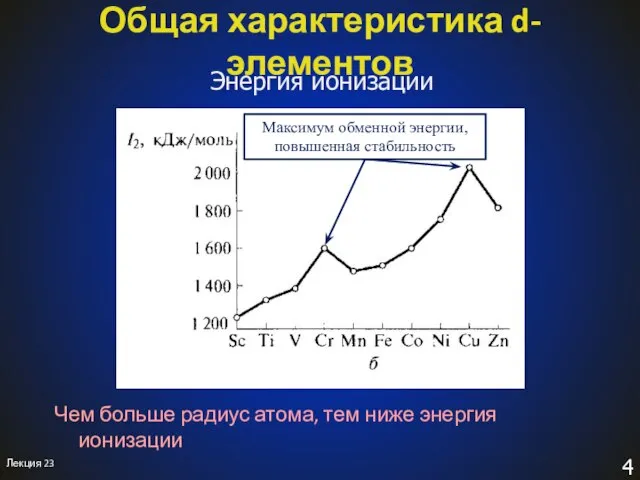
- 4. Лекция 23 Общая характеристика d-элементов Энергия ионизации Чем больше радиус атома, тем ниже энергия ионизации Максимум
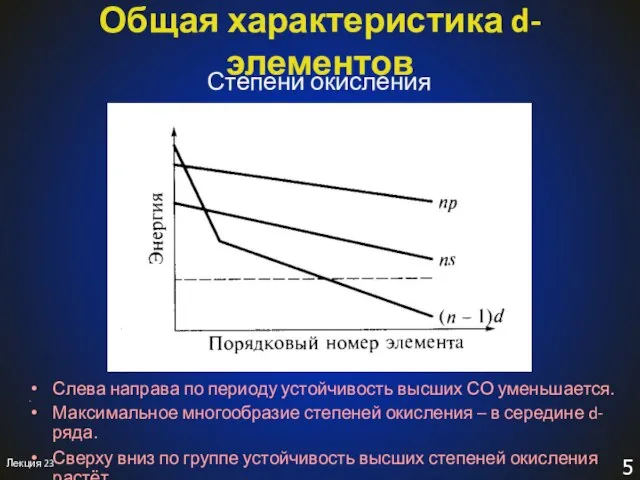
- 5. Лекция 23 Общая характеристика d-элементов Степени окисления Слева направа по периоду устойчивость высших СО уменьшается. Максимальное
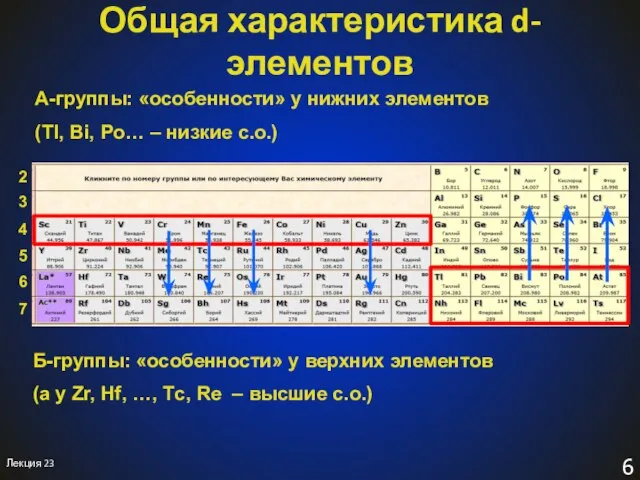
- 6. Общая характеристика d-элементов Лекция 23 А-группы: «особенности» у нижних элементов (Tl, Bi, Po… – низкие с.о.)
- 7. Лекция 23 Общая характеристика d-элементов Отличия свойств элементов 4 периода, сходство свойств эл-тов 5 и 6
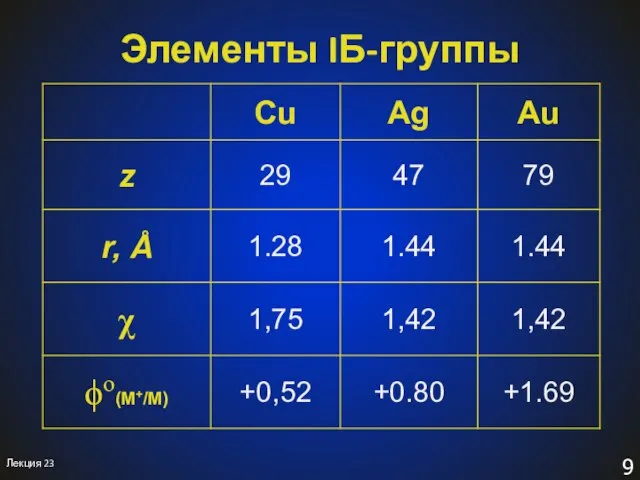
- 8. Элементы IБ-группы Лекция 23 Cuprum – от лат. «cyprium» (кипрcкая) Медь – точная этимология неизвестна Argentum
- 9. Элементы IБ-группы Лекция 23
- 10. Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления: 0, +I, +II, +III КЧ: 2
- 11. Степени окисления Лекция 23
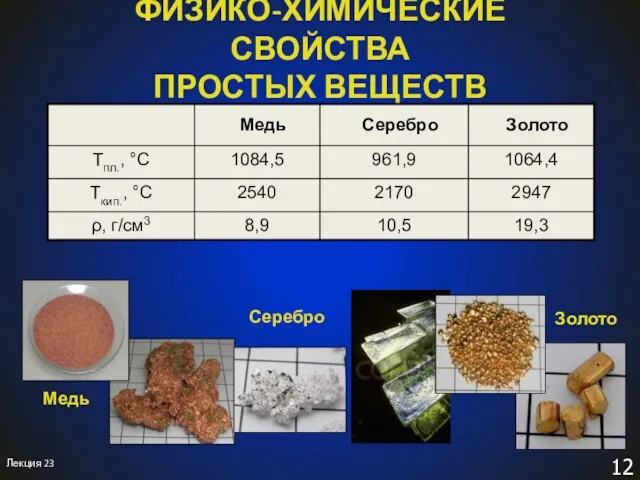
- 12. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ Лекция 23
- 13. Распространение в природе и важнейшие минералы В земной коре: 26. Cu 0,01% масс. 69. Ag 1·10–5
- 14. Минералы халькопирит (Fe,Cu)S2 халькозин Cu2S ковеллин CuS куприт Cu2O малахит Cu2(CO3)2(OH)2 аргентит Ag2S хлораргирит AgCl калаверит
- 15. Получение меди 2(FeIIICuI)S2 + 5 O2 + 2SiO2 = 2Cu0 + 2FeSiO3 + 4SO2↑ халькопирит обжиг/связывание
- 16. Электрохимическое рафинирование меди Лекция 23 анод: Cu0 – 2e– = Cu2+ катод: Сu2+ + 2e– =
- 17. В ЭХРН: …H ... Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au ϕ°, В: +0,34 +0,799 +1,00 ЭIБ
- 18. Химическое растворение В «царской водке» (до ст. ок. +III) Au + HNO3 + 4HCl = H[AuCl4]
- 19. Добыча золота Лекция 23
- 20. Цианидный метод извлечения золота и серебра ЭIБ(Ag,Au) + NaCN(р) + O2 → [Э(CN)2]− + OH− измельч.
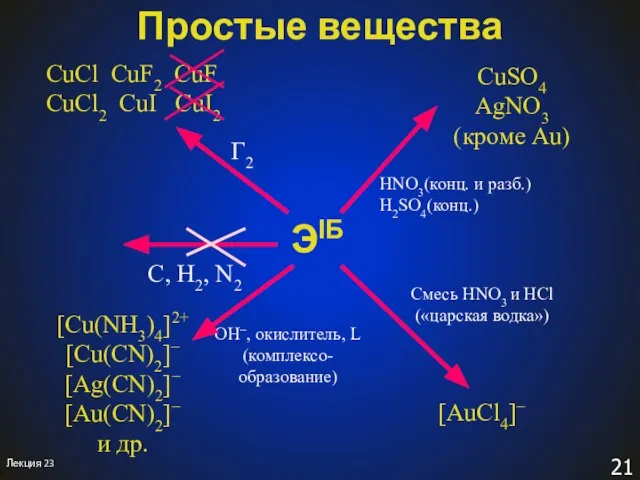
- 21. ЭIБ C, H2, N2 Г2 CuCl CuF2 CuF CuCl2 CuI CuI2 CuSO4 AgNO3 (кроме Au) HNO3(конц.
- 22. Кислородные соединения Cu Ag, Au +I: Cu2O красный, Тпл. = 1240 °С (уст.) +II: CuO чёрный,
- 23. Соединения меди(I) 2Cu+I ⮀ Cu0 + Cu+II Cu2O + H2SO4 = Cu0 + CuSO4 + H2O
- 24. Гидроксид Cu(OH)2 Получение: Cu2+ + 2OH─ = Cu(OH)2↓ Амфотерность: Cu(OH)2 + 2H3O+ = = [Cu(H2O)4]2+ Cu(OH)2
- 25. 1. Получение: 2AgNO3 + 4NaOH + Na2S2O6(O2) = Ag2O2↓ + + 2H2O + 2Na2SO4 + 2NaNO3
- 26. Соли меди(II) Гидролиз: [Cu(H2O)4]2+ + H2O ⮀ [Cu(H2O)3(OH)]+ + H3O+ Kк = 4.6·10-8 pH 2Na2CO3 +
- 27. Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O = = [Cu(NH3)4(H2O)2]2+ + 8H2O Длинные транс-связи: Cu–N: 2.05
- 28. Комплексные соединения меди(II) dsp2 (квадрат): [Cu (NH3)4(H2O)2]2+, [Cu(H2O)2Cl4]2–, [Cu(NH3)2(H2O)2(NO2)2] Лекция 23 sp3 (тетраэдр): [Cu(OH)4]2− (в усл.
- 29. Окислительно-восстановительные свойства CuSO4 + Fe = Cu↓ + FeSO4 ϕ(Cu2+/Cu) = +0.34В 2CuSO4 + 5KI =
- 30. Соединения серебра(I) 1. Гидролиз: Ag·H2O+ + H2O ⮀ AgOH + H3O+ Кк = 1.0·10-12 2. Растворимые
- 31. 4. Малорастворимые соли: AgNO3 + NaX = AgX↓ + NaNO3 (X = Cl, Br, I) 2Ag+
- 32. 5. Комплексообразование (растворение осадка): AgX(т) + 2NH3·H2O = [Ag(NH3)2]X + 2H2O AgCl(т) + 2NH3 = [Ag(NH3)2]+
- 33. 6. Окислительно-востановительные свойства Реакция серебряного зеркала 2[Ag(NH3)2]+ + 2OH- + C6H12O6 + 2H2O = = 2Ag↓
- 35. Скачать презентацию
![Лекция 23 Общая характеристика d-элементов Общая электронная формула: […] (n–1)d1-10 ns0-2 IIБ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/889796/slide-1.jpg)



![Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления: 0, +I,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/889796/slide-9.jpg)





![В ЭХРН: …H ... Cu …Ag …Au Сu2+/Cu Ag+/Ag [AuСl4]–/Au ϕ°, В:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/889796/slide-16.jpg)







![Соли меди(II) Гидролиз: [Cu(H2O)4]2+ + H2O ⮀ [Cu(H2O)3(OH)]+ + H3O+ Kк =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/889796/slide-25.jpg)
![Комплексные соединения Cu2+(р): [Cu(H2O)4(H2O)2]2+ [Cu(H2O)4(H2O)2]2+ + 4NH3·H2O = = [Cu(NH3)4(H2O)2]2+ + 8H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/889796/slide-26.jpg)
![Комплексные соединения меди(II) dsp2 (квадрат): [Cu (NH3)4(H2O)2]2+, [Cu(H2O)2Cl4]2–, [Cu(NH3)2(H2O)2(NO2)2] Лекция 23 sp3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/889796/slide-27.jpg)



![5. Комплексообразование (растворение осадка): AgX(т) + 2NH3·H2O = [Ag(NH3)2]X + 2H2O AgCl(т)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/889796/slide-31.jpg)
![6. Окислительно-востановительные свойства Реакция серебряного зеркала 2[Ag(NH3)2]+ + 2OH- + C6H12O6 +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/889796/slide-32.jpg)
 Ароматические углеводороды
Ароматические углеводороды Простое вещество и химический элемент азот
Простое вещество и химический элемент азот Циклические эфиры (окиси)
Циклические эфиры (окиси) Смеси веществ
Смеси веществ Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов
Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов Диффузия в металлах и сплавах
Диффузия в металлах и сплавах Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Электролитическая диссоциация
Электролитическая диссоциация Аналитическая химия (ЛЕКЦИЯ 1)
Аналитическая химия (ЛЕКЦИЯ 1) Получение и химические свойства металлов
Получение и химические свойства металлов Презентация на тему Альдегиды, свойства, получение, применение
Презентация на тему Альдегиды, свойства, получение, применение  Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире Составление химических уравнений
Составление химических уравнений Биологическое значение брома и йода
Биологическое значение брома и йода Многообразие веществ
Многообразие веществ Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Олигосахариды и полисахариды
Олигосахариды и полисахариды Основания. Классификация. Химические и физические свойства
Основания. Классификация. Химические и физические свойства Железо и его соединения
Железо и его соединения агрегатные состояния вещества 7 класс
агрегатные состояния вещества 7 класс Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Приобретённые: недостаточность митохондрий,
Приобретённые: недостаточность митохондрий, Стекло. Виды стекла
Стекло. Виды стекла ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Общая характеристика металлов
Общая характеристика металлов