Слайд 2МЕТАЛЛЫ. СТРОЕНИЕ, СВОЙСТВА, ПРИМЕНЕНИЕ
«Металл суть светлое тело,
которое ковать можно».
Ломоносов М.В.

Слайд 3Содержание
Характеристика элемента-металла по положению в ПСХЭ
Изменение металлических свойств в ПСХЭ
Металлы – простые

вещества
Химическая связь в металлах
5-6.Физические свойства
Металлы – рекордсмены
О применении металлов
Металлы древности на службе у человека
10-11. Из истории сплавов
12-18. Чугун-материал для создания шедевров мирового искусства
О роли металлов
Используемая литература
21. Авторская страница
Слайд 4Характеристика элемента – металла по положению в ПСХЭ Д.И.Менделеева
Li B 1.

Металлы находятся в I-III группе главной
подгруппе (искл. H -1e, Hе-2e, B-3e),
а также в I-VIII группах побочной подгруппе.
Fr At 2. На внешнем энергетическом уровне у
металлов от 1 до 3-х электронов.
3. Ме0 - п е = Ме+п (окисление)
восстановитель
4. Степень окисления металла:
0, +1, +2, +3 (низшая)
+4, +5, +6, +7, +8 (высшая)
Слайд 5 Понятие металлов. Положение в периодической системе.
Металлы – это химические элементы, атомы

которых
способны только отдавать электроны, имеют низкие значения электроотрицательности (от 0,7 до 2,0), им соответствуют простые вещества, металлы.
М е т а л л ы
все s-элементы некоторые р-элементы
(кроме Н и Не) (III-VI групп) І-А, ІІ-А группа Аl, Sn, Bi…
все d- и f-элементы
Cu, Zn, Cr, Mn…
Чем отличается строение атомов металлов от атомов
неметаллов и как это отражается на их химических
свойствах?
Низшая степень окисления Ме = 0, высшая =№ группы (искл.Ι-Б и VΙΙ-Б).
Слайд 6Ряд стандартных электродных потенциалов металлов.
Положение того или иного металла в ряду

напряжений характеризует его способность к окислительно-восстановительным взаимодействиям в водных растворах при стандартных условиях.
Чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет металл как простое вещество.
Чем дальше расположен металл в ряду напряжений, тем более сильными окислителями в водном растворе являются его ионы.
Слайд 7Изменение металлических свойств в ПСХЭ
В группах: металлические свойства усиливаются
причина:

1.увеличивается заряд ядра,
2.число электронов на внешнем э.у.
не изменяется
3.радиус атома увеличивается
В периодах:
металлические свойства уменьшаются
причина: 1. увеличивается заряд ядра
2. число электронов на внешнем э.у.
увеличивается
3. радиус атома уменьшается
Слайд 8Металлы –простые вещества
Типы кристаллических решёток металлов
Кубическая Объёмно-центрированная
кубическая
Гранецентрированная Гексагональная
кубическая
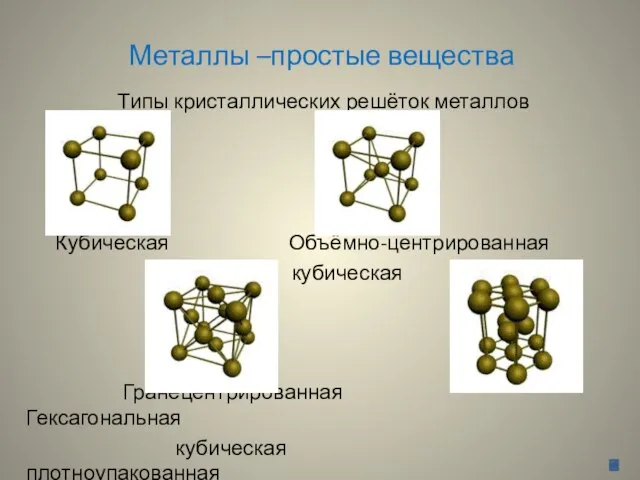
плотноупакованная
Слайд 9Химическая связь в металлах
В узлах кристаллической решётки атом-ионы, между которыми свободно

перемещаются свободные электроны («электронный газ»)
Металлическая связь – связь
между атом-ионами и относительно
свободными электронами за счёт
сил электростатического притяжения
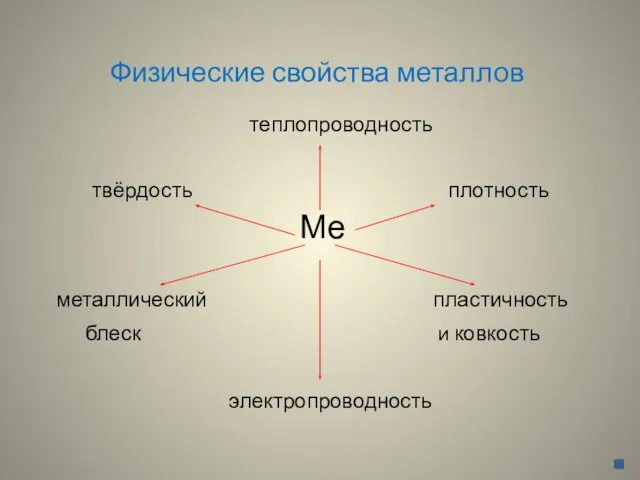
Слайд 10Физические свойства металлов
теплопроводность
твёрдость плотность
Ме
металлический пластичность
блеск и ковкость
электропроводность
Слайд 11 Общие физические свойства металлов.
Пластичность
Au, Ag, Cu, Sn, Pb, Zn, Fe

(уменьшается) Au–0,003 мм
Электропроводность, теплопроводность
Ag, Cu, Au, Аl, Fe (уменьшается)
Классификация металлов:
а) по плотности (лёгкие и тяжелые); б) по температурам плавления (легкоплавкие и тугоплавкие); в) по твёрдости (мягкие и твердые); г) по отношению к магнитному полю (ферромагнетики и парамагнетики)
Слайд 12Физические свойства металлов
(продолжение)
Физические свойства металлов:
пластичность, металлический блеск,
теплопроводность и

электропро-
водность обусловлены наличием в
кристаллической решётке металлов
свободных электронов - «электронный газ».
Слайд 13Металлы - «рекордсмены»
W - самый тугоплавкий
Ag - самый электропроводный
Li

- самый лёгкий
AI - самый распространённый
Cs - самый легкоплавкий
Au - лучший катализатор
Cr - самый твёрдый
Os - самый тяжёлый
Слайд 14Металлы древности на службе
у человека
Семь металлов создал свет
по числу

семи планет …
Алхимики
Золото (Au) – солнце
Серебро (Ag) – луна
Ртуть (Hg) – меркурий
Медь (Cu) – меркурий
Железо (Fe) – марс
Олово (Sn) – юпитер
Свинец (Pb) – сатурн
Слайд 15О применении металлов
Медь была первым металлом,
которым овладел человек. Она

открыла эру металлургии и дала
миру первый сплав. Многие
тысячелетия медь была основой
материальной культуры и искусств
Трудно переоценить уникальную
роль меди в истории
человеческой цивилизации.
Слайд 16«Металлы отверзают недро земное к плодородию; металлы служат нам в ловлении земных

и морских животных для пропитания нашего; металлы облегчают купечество удобною к сему монетою…
И кратко сказать, ни едино художество, ни едино ремесло простое употребление металлов миновать не может»
(М.В.Ломоносов)
Слайд 18 Родий. Стоимость примерно за 1 гр 225 долларов. На Земле его

всего несколько тонн.
Используется, в основном, как автомобильный катализатор
Добывают в ЮАР, встречается в Заполярье, Норильске, на Урале.
Слайд 19Платина – «белое золото»
Стоимость – примерно за 1 гр 70 долларов

Золото
Стоимость – примерно за 1 гр 30 долларов
Слайд 20Иридий
(за 1 гр 17 долларов)
Открыт в 1803 году.
Внешне похож на олово, твердый.

тяжелый.
Иридий идет на изготовление эталонов длины и веса, химических весов, хирургических инструментов.
Слайд 21Осмий
(стоимость за 1 гр 10 000 долларов)
Osme (запах) – греческое слово.
Оно

дало название платиновому металлу осмию 200 лет назад. У него неприятный раздражающий запах, он похож на смесь хлорки и чеснока. В природе чистого осмия не найдено. Металл очень хрупкий, его просто растолочь в обычной ступке.
Используют в фармакологической отрасли в качестве катализатора во многих хим. процессах. Применяют для изготовления деталей измерительных приборов.
Слайд 22КАЛИФОРНИЙ-252
(стоимость за 1 гр – 6 млн.500 тыс. долларов)
В мире его

всего несколько граммов (около 5). Его вырабатывают 2 реактора (США, Россия). Каждый производит около 20-40 мгр в год. 2 грамма металла в 1 секунду выделяет 2,4 биллиарда нейтронов, что соответствует нейтронному потоку обычного реактора (такой эффект можно получить с использованием 200 кг радия).
Калиформий-252 используется в медицине для обработки злокачественных опухолей.
Калифорний может заменить средний атомных реактор.
Слайд 24Активные металлы и металлы средней активности

Слайд 25ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Металлы – восстановители
Металлы взаимодействуют с :
Кислородом
Неметаллами
Водой (активные)
Кислотами (только

металлы, стоящие до Н в ряду активности металлов)
Солями (условие: металл в соли должен быть менее активным)
Слайд 26Из истории сплавов
Бронза была первым сплавом,
полученным человеком.
Распространение бронзы
началось
с конца 4 тыс. до н.э. Древнейшие
бронзовые изделия найдены на
территории Ирана, Месопотамии, Турции. В конце 3 тыс. до н.э. бронза появилась в Индии, во 2 тыс. до н.э. – в Китае и Европе.
В Америке бронзовый век охва-
тывает период с VI по Х века н.э.
Слайд 27Из истории сплавов
(продолжение)
В железный век первыми пришли
народы Африки. Они перешагнули

из каменного века в железный
минуя медный и бронзовый. Это
связано с тем, что в Африке железные
руды выходят на поверхность земли.
Африканцы изобрели плавку железа в 600-400
годах до новой эры.
Слайд 28Чугун –материал для создания шедевров мирового искусства
Санкт-Петербург –своеобразный музей, в котором

собрано бесчисленное множество произведений
изобразительного искусства, выполненных из чугуна.
Рассмотрит лишь некоторые
из них – чугунные ограды
дворцов и набережных рек
Санкт – Петербурга.
Слайд 29Чугун – материал для создания шедевров мирового искусства (продолжение)
Воронихинская решётка у Казанского
собора.

Отлита в 1811 году.
(Архитектор Воронихин А.Н.)
Слайд 30Чугун –материал для создания шедевров мирового искусства (продолжение)
Решётка Летнего сада. 36

гранитных колонн, увенчанных вазами и урнами, и тончайшие ажурные звенья, украшенные позолоченными розетками, стали сокровищем мирового искусства.
(Архитекторы Фельтен Ю.М. и Егоров П.Е.)
Слайд 31Чугун – материал для создания шедевров мирового искусства (продолжение)
Ограда Русского

музея
(Михайловского дворца),
1819-1825 г
(Архитектор Росси К.И.)
До 1917 года назывался
музеем Александра III.
Слайд 32 Чугун – материал для создания шедевров мирового искусства (продолжение)
Ограда набережной

реки Фонтанки. Сооружена в 1780-1789 г по проекту архитектора Квасова А.В.
Слайд 33Чугун –материал для создания шедевров мирового искусства (продолжение)
Ограда набережной
реки

Мойки
(1798-1810 годы)
































 Реакции ионного обмена
Реакции ионного обмена Введение в химию. История химии
Введение в химию. История химии ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов
ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов Щелочные металлы
Щелочные металлы Способы получения веществ 14 (IVА) группы элементов
Способы получения веществ 14 (IVА) группы элементов teoriya_elektroliticheskoy_dissotsiatsii
teoriya_elektroliticheskoy_dissotsiatsii Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия
Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия Теория строения органических соединений А.М.Бутлерова
Теория строения органических соединений А.М.Бутлерова Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Сахароза, крахмал, целлюлоза
Сахароза, крахмал, целлюлоза Жиры. Определение и общая формула
Жиры. Определение и общая формула Квантовая химия
Квантовая химия Структура металлов, сплавов, интерметаллидов и квазикристаллов
Структура металлов, сплавов, интерметаллидов и квазикристаллов e169ef73a24f42198b95276fd042e8b8
e169ef73a24f42198b95276fd042e8b8 Гальванический элемент. Коррозия
Гальванический элемент. Коррозия Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Лекция 2 Классы неорганических соединений (1)
Лекция 2 Классы неорганических соединений (1) Фосфор туралы
Фосфор туралы Металлы. Д.И. Менделеев
Металлы. Д.И. Менделеев Алкины. Строение
Алкины. Строение Классификация_органических_соединений[1]
Классификация_органических_соединений[1] Современные представления о строении атома
Современные представления о строении атома Вода как растворитель. Растворы. Растворимость. 8 класс
Вода как растворитель. Растворы. Растворимость. 8 класс Витамины. Способы получения
Витамины. Способы получения Вяжущие вещества
Вяжущие вещества Алкилирование. Алкилирующие агенты
Алкилирование. Алкилирующие агенты Общая характеристика криптона
Общая характеристика криптона Классификация неорганических веществ
Классификация неорганических веществ