Слайд 2Алотропія - явище існування хімічного елемента у вигляді двох або кількох простих

речовин, різних за властивостями і будовою.
Алотропними видозмінами (форми, модифікації) хімічного елемента – це прості речовини утворені одним і тим самим елементом.
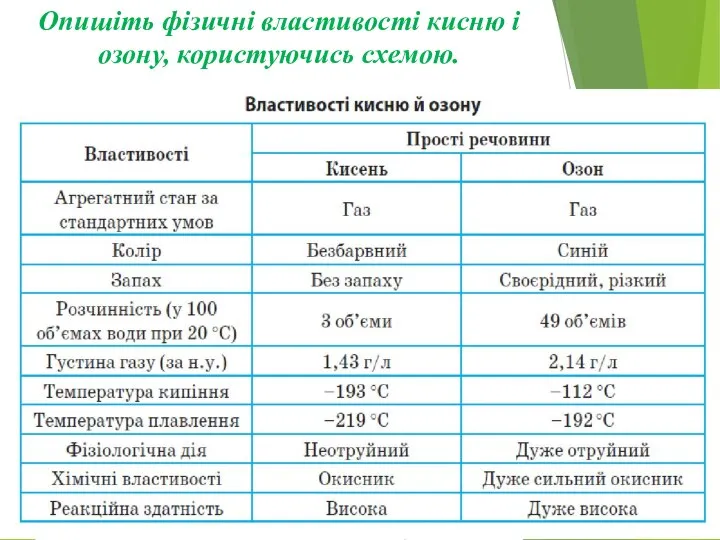
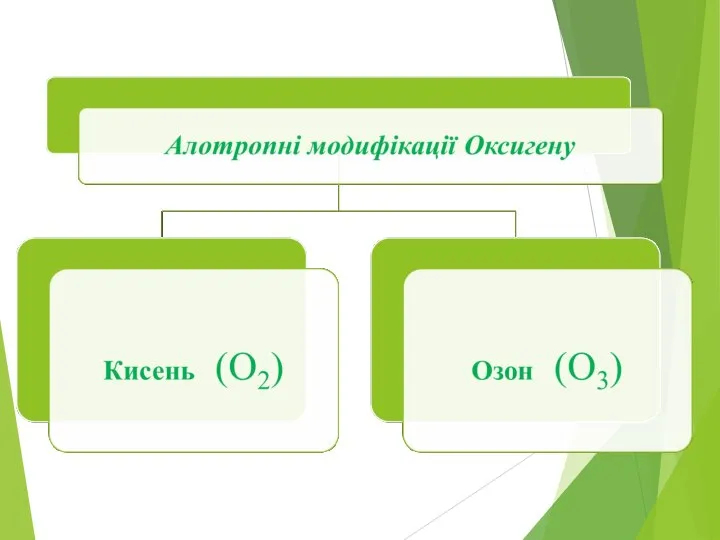
Слайд 4Опишіть фізичні властивості кисню і озону, користуючись схемою.
Слайд 5Чим зумовлена алотропія у Оксигену?
Алотропія у Оксигену зумовлена різною кількістю атомів, що
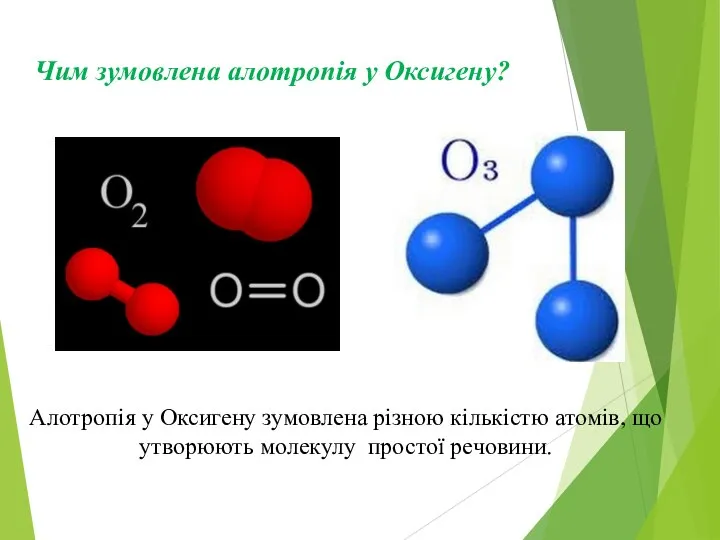
утворюють молекулу простої речовини.
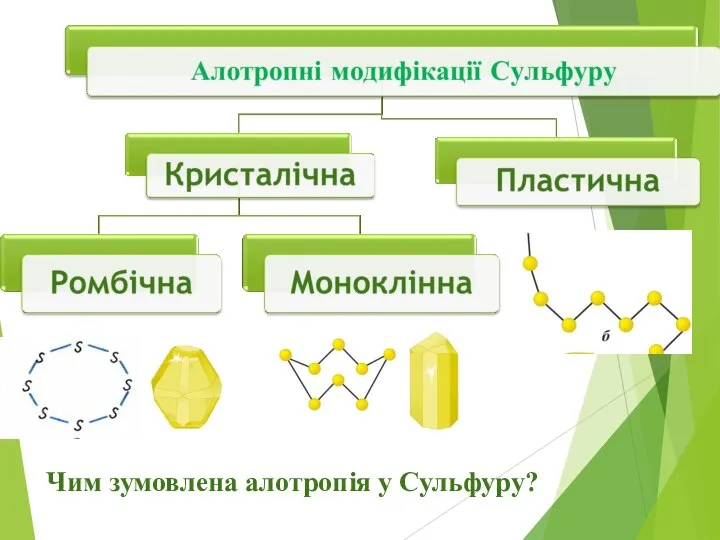
Слайд 6Чим зумовлена алотропія у Сульфуру?
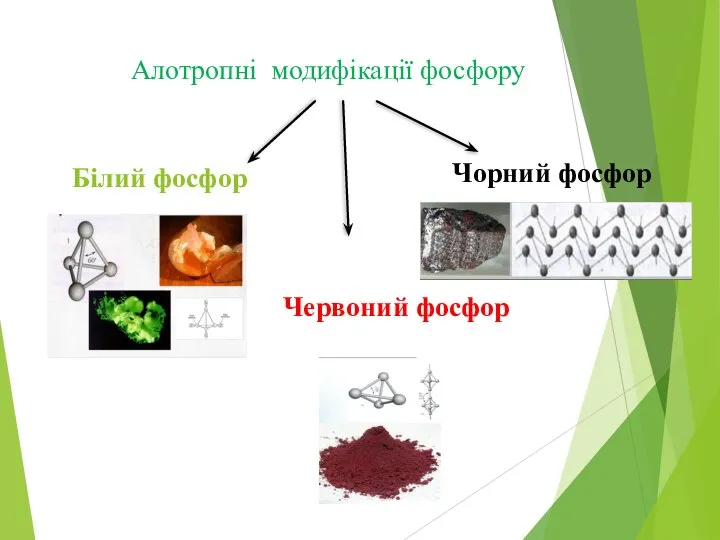
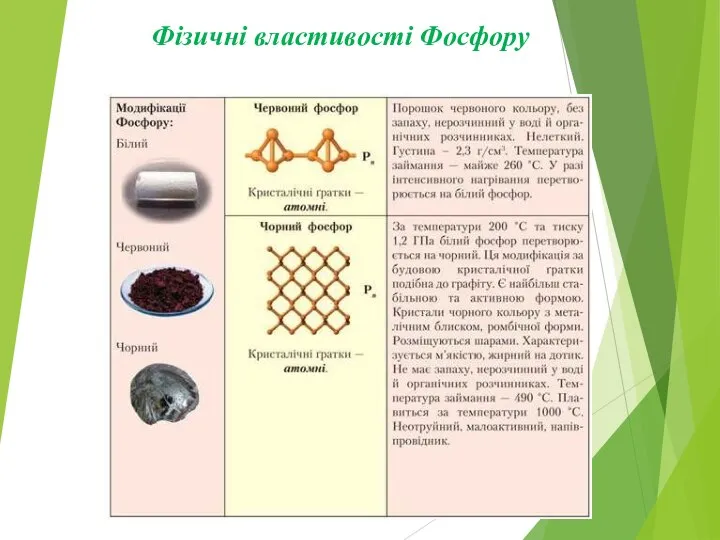
Слайд 8Алотропні модифікації фосфору
Білий фосфор
Червоний фосфор
Чорний фосфор
Слайд 10Білий фосфор Р4
Білий, кристалічний порошок
Молекулярна кристалічна ґратка.
Нерозчинний у воді.
Світиться.
Діелектрик.
Легкоплавкий.
Леткий.
Часниковий запах.
Отруйний

Слайд 11Червоний фосфор Рn
Червоний порошок
Атомна кристалічна гратка.
Нерозчинний у воді.
Не світиться.
Діелектрик.
Нелеткий.
Без запаху.
Не

отруйний
Слайд 12Чорний фосфор Рn
Чорний графітоподібний порошок
Атомна кристалічна ґратка (шарувата, як у графіта).
Нерозчинний

у воді.
Не світиться.
Напівпровідник.
Масний на дотик.
Нелеткий.
Без запаху.
Не отруйний
Слайд 14Алмаз
Алмаз має атомну кристалічну гратку. Кожен атом Карбону сполучений з 4

іншими атомами Карбону σ – зв’язками.
Безбарвні прозорі кристали, що сильно заломлюють світло.
Виняткова твердість.
Тугоплавкий.
Погано проводить тепло і не проводить струм.
Не розчиняється у воді.
Слайд 15Застосування алмазу
Ювелірні вироби
(заломлює світло)
Для різання скла, шліфування, буріння
(дуже твердий)

Слайд 16Графіт
Графіт має атомну кристалічну гратку.
Утворює пласкі шари: атоми Карбону розміщуються

шарами, відстань між якими значно більша, ніж між атомами в одному шарі. Електрони, що зв’язують шари, утворюють єдину електронну хмару, як це відбувається в металах. Саме цим пояснюються електропровідність графіту, його металічний блиск.
М̕’яка темно-сіра речовина, непрозора.
З металічним блиском.
Маский на дотик.
Тугоплавкий (tпл = 3800ºС)
Добре проводить тепло і струм.
Не розчиняється у воді.
Легко розшаровується.
Слайд 17Застосування графіту
Грифелі для олівців
Графітові тиглі
Електроди
Мастило для машин
Добавка до фарби

Слайд 18Карбін
Карбін складається з довгих ланцюгів атомів Карбону, сполучених між собою подвійними

або одинарними і потрійними зв’язками. Чорний дрібнокристалічний порошок.
Напівпровідник. Під дією світла його електропровідність зростає, тому карбін застосовують у фотоелементах.
За твердістю перевершує графіт, але м’якший за алмаз
Слайд 19Фулерен (букибол)
Молекули фулерену мають форму сфери або еліпсоїда і побудовані з п’яти-

або шестикутників Карбону.
Атоми вуглецю в молекулі фулерену пов'язані σ- і π-зв'язками
Слайд 20Застосування фулерену
Нанотехнології
У лазерних установках
Напівпровідник
Виробництво штучних алмазів


















 Тест 1 задание
Тест 1 задание Химические свойства оксидов
Химические свойства оксидов Минеральные компоненты молока и молочных продуктов. Макроэлементы
Минеральные компоненты молока и молочных продуктов. Макроэлементы Периодический закон Д.И.Менделеева
Периодический закон Д.И.Менделеева Полимеры
Полимеры Гидролиз солей
Гидролиз солей Углеводороды
Углеводороды Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Получение гидроген хлорида
Получение гидроген хлорида Изомерия, её виды
Изомерия, её виды Строение органических соединений
Строение органических соединений Степень окисления
Степень окисления Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас Нефть по ГОСТ Р 51858-2002
Нефть по ГОСТ Р 51858-2002 Применение некоторых химических веществ. Задание 1
Применение некоторых химических веществ. Задание 1 Презентация на тему Этиловый спирт и его влияние на организм человека
Презентация на тему Этиловый спирт и его влияние на организм человека  Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Соли. Для учащихся 8 класса
Соли. Для учащихся 8 класса Железо как химический элемент
Железо как химический элемент Строение вещества
Строение вещества Строение, свойства и функции аминокислот и белков
Строение, свойства и функции аминокислот и белков Галогенпроизводные углеводородов
Галогенпроизводные углеводородов Fyzikálne a chemické deje
Fyzikálne a chemické deje Фуллерены (шары Бакминстера)
Фуллерены (шары Бакминстера) Основания: номенклатура, классификация, применение, физические свойства
Основания: номенклатура, классификация, применение, физические свойства Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей
Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей Что такое бинарные соединения?
Что такое бинарные соединения? Массовая доля химич элемента
Массовая доля химич элемента