Содержание
- 2. Кинетическая устойчивость комплексов Термодинамика отражает только тот факт, что комплекс может получиться. Кинетика показывает быстро или
- 3. Инертные и лабильные комплексы [Fe(H2O)6]3+ и [Cr(H2O)6]3+ имеют близкие значения константы образования и, значит, приблизительно одинаковую
- 4. [Ni(CN)4]2- β4 = 1022, термодинамически очень стабилен: C[Ni(CN)4]2- = CCN- = 1 моль/литр СNi2+ = 10-22
- 5. Методы синтеза КС Реакции обмена в водных растворах Реакции обмена в неводных растворах Окислительно-восстановительные реакции в
- 6. 1. Реакция NiCl2 в воде с аммиаком (получение) [Ni(H2O)6]2+ + 6NH3 = [Ni(NH3)6]2+ + 6H2O зеленый
- 7. II. Реакции синтеза в неводных растворах Реакция в воде приводит к гидролизу! [Cr(H2O)6]3+ + 3en =
- 8. Окислительно-восстановительные реакции в растворах 1. Комплексы Co3+ кинетически инертны, поэтому их часто получают окислением соответствующих комплексов
- 9. ХИМИЯ ЭЛЕМЕНТОВ
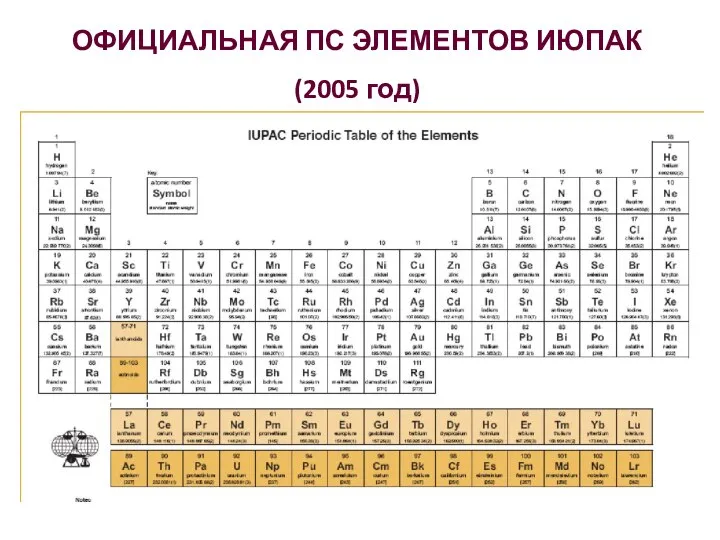
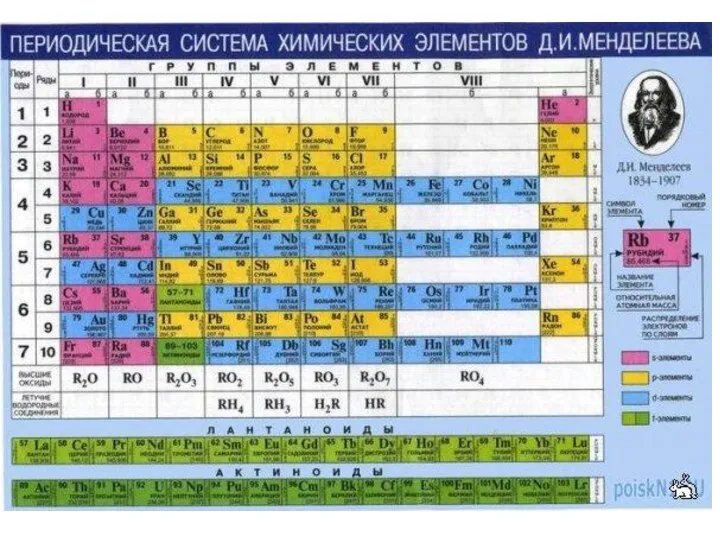
- 10. ОФИЦИАЛЬНАЯ ПС ЭЛЕМЕНТОВ ИЮПАК (2005 год)
- 12. Водород Н – самый распространенный элемент Вселенной, 5 место по распространенности на Земле. Вода, минералы, все
- 13. Изотопы водорода 1H – протий; 2H (D) – дейтерий (0,011%); 3H (T) – тритий (радиоактивный изотоп,
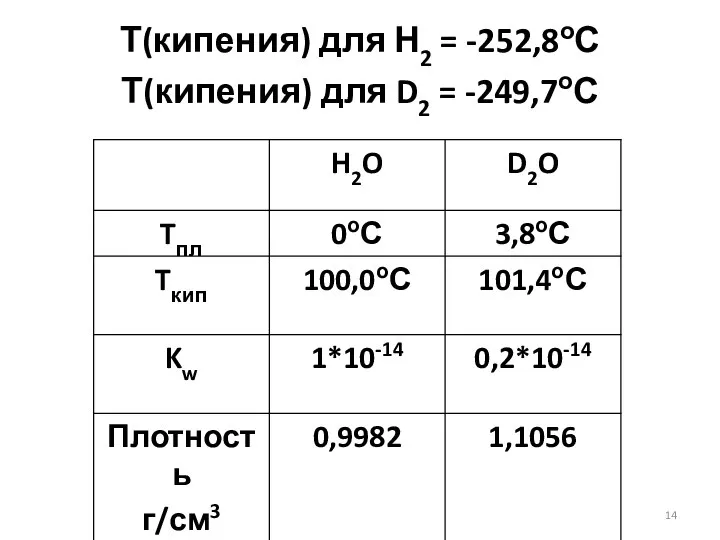
- 14. Т(кипения) для Н2 = -252,8оС Т(кипения) для D2 = -249,7оС
- 15. Получение диводорода 1. Каталитическая конверсия метана водяным паром (1000оС) CH4 + H2O CO + 3H2 (соотношение
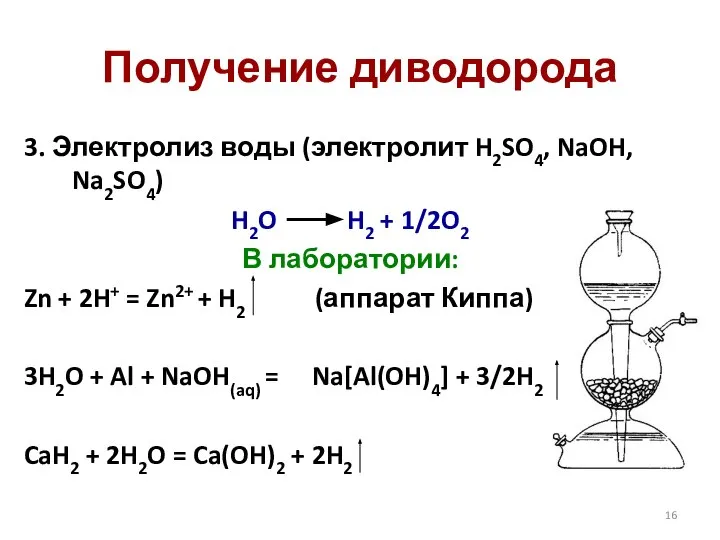
- 16. Получение диводорода 3. Электролиз воды (электролит H2SO4, NaOH, Na2SO4) H2O H2 + 1/2O2 В лаборатории: Zn
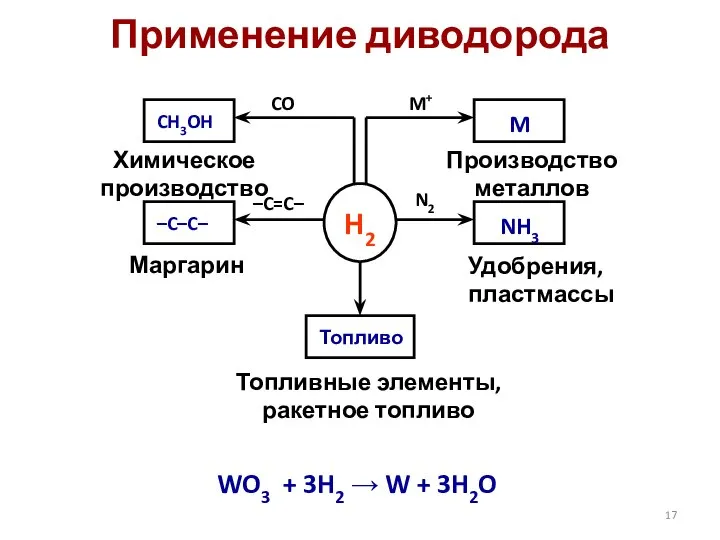
- 17. Применение диводорода WO3 + 3H2 → W + 3H2O H2 –C–C– –C=C– CO M+ N2 Химическое
- 18. СИНТЕЗ-ГАЗ (сигаз), смесь газов, главными компонентами которой являются СО и Н2; используется для синтеза разных химических
- 19. В 1926 году была опубликована работа Ф. Фишера и Г. Тропша "О прямом синтезе нефтяных углеводородов
- 20. Водородная энергетика Основной вид топлива – диводород, получаемый из воды (электролиз воды или фотохимическое разложение воды
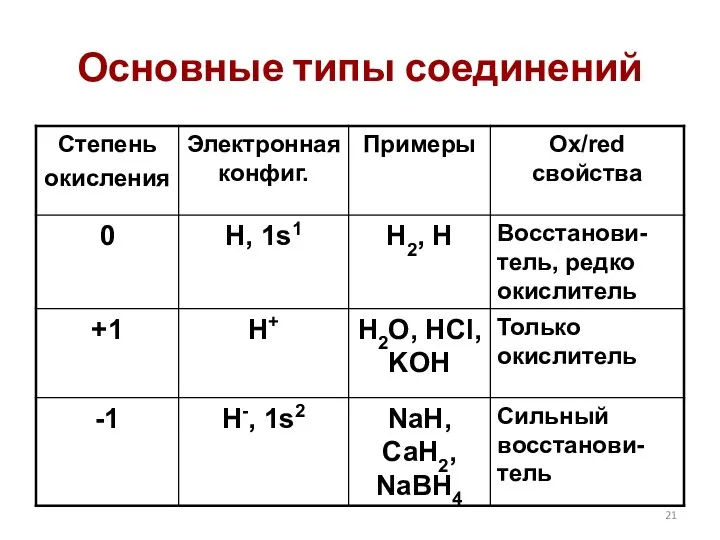
- 21. Основные типы соединений
- 22. Н2 восстановитель CuO(тв) + H2(г) = Cu(тв) + H2O(г) H2 + Cl2 = 2HCl 2H2 +
- 23. Н+ только окислитель 2HCl + Zn = ZnCl2 + H2 H2O + K = KOH +
- 24. Реакции диводорода Низкая реакционная способность H2 Гомолитический разрыв связи Н-Н: H-H = H + H ΔHo
- 25. Молекулярные соединения Электронодостаточные молекулярные соединения – все валентные электроны центрального атома участвуют в образовании связей. (двухцентровые-2е)-связи.
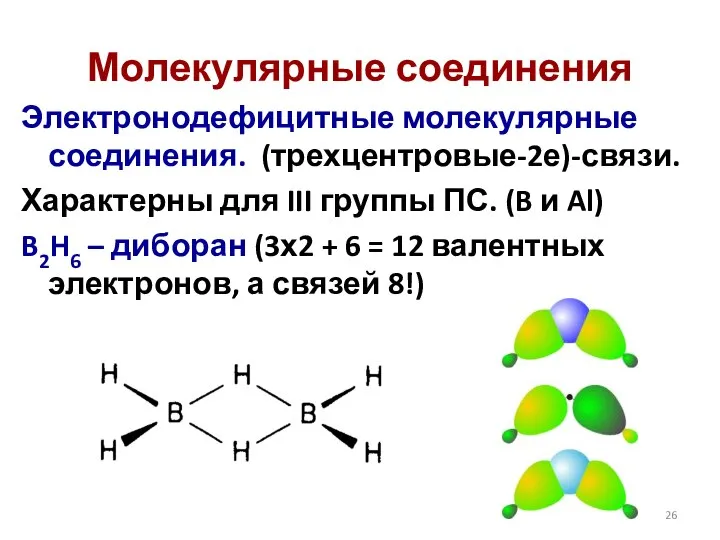
- 26. Электронодефицитные молекулярные соединения. (трехцентровые-2е)-связи. Характерны для III группы ПС. (B и Al) B2H6 – диборан (3х2
- 27. Электроноизбыточные соединения – есть свободные электронные пары. Характерны для элементов V, VI и VII групп ПС.
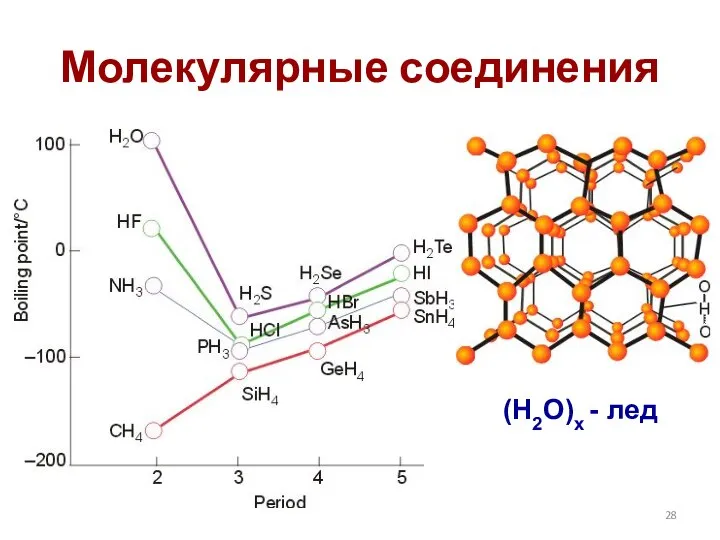
- 28. Молекулярные соединения (H2O)x - лед
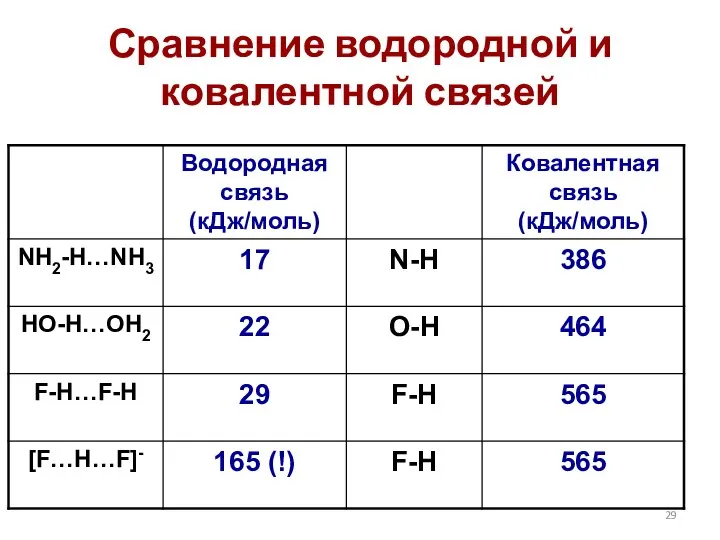
- 29. Сравнение водородной и ковалентной связей
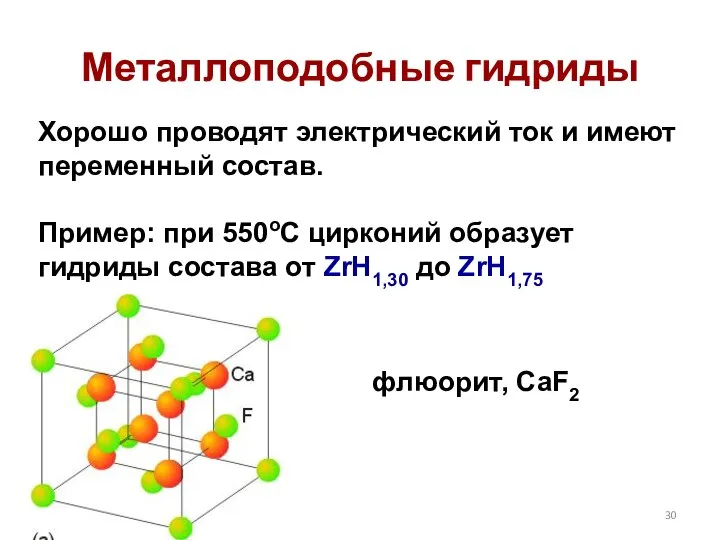
- 30. Металлоподобные гидриды Хорошо проводят электрический ток и имеют переменный состав. Пример: при 550оС цирконий образует гидриды
- 31. Атомарный водород «Н» Гораздо более реакционноспособен, чем Н2 Получение 1) Из диводорода в электрическом разряде 2)
- 32. Орто- и параводород T = 20oC; 25% пара-H2 (газ) T = -253oC; 99,8% пара-H2 (жидкость)
- 33. Орто- и параводород Процесс орто-пара конверсии является экзотермическим. При температуре кипения водорода Т = 20,4 К
- 34. VII группа периодической системы
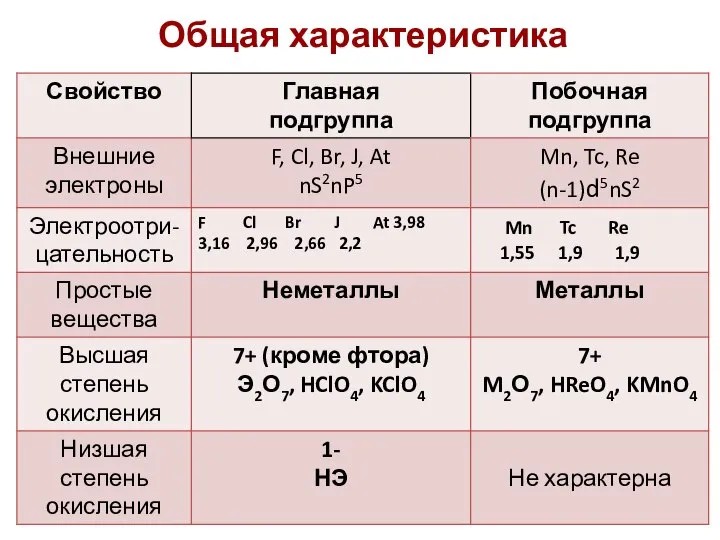
- 35. Общая характеристика
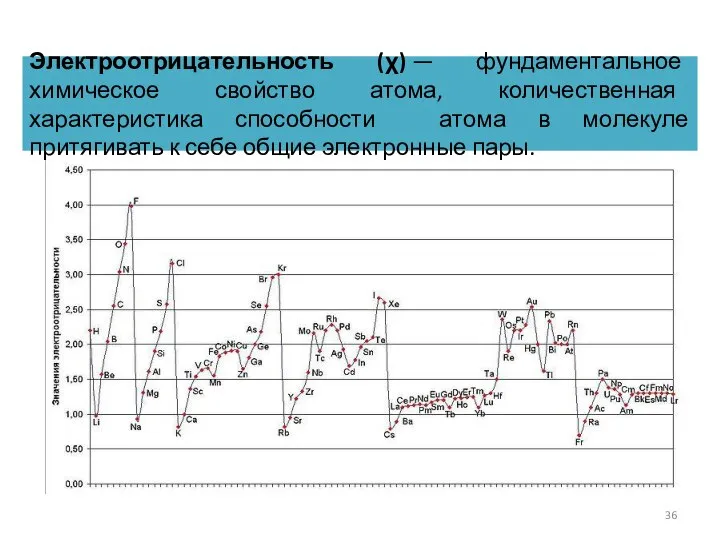
- 36. Электроотрицательность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе
- 37. ГАЛОГЕНЫ
- 38. Распространенность в природе F> Cl >Br > J >> At (τ1/2 (210At) = 8,1 часа) CaF2
- 39. Открытие элементов F2 - открыт в 1886 г., Муассан (Франция) Cl2 - открыт в 1774 г.
- 40. В 1906 г. Муассану была присуждена Нобелевская премия по химии «за большой объем проделанных им исследований,
- 41. Нобелевский диплом Муассана
- 42. Происхождение названий F – греческое фторос – разрушение, гибель Cl – греческое хлорос – желто-зеленый Br
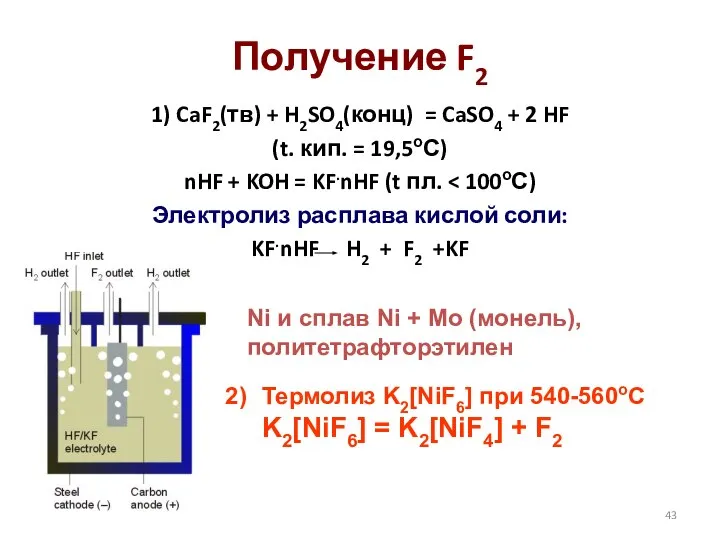
- 43. Получение F2 1) CaF2(тв) + H2SO4(конц) = CaSO4 + 2 HF (t. кип. = 19,5оС) nHF
- 44. Получение Cl2 ЭЛЕКТРОЛИЗ Расплав: NaCl = Na + 1/2Cl2 Рассол: 2Cl- - 2ē = Cl2 (анод)
- 45. Лабораторные способы получения Cl2 Взаимодействие конц. HCl с разными окислителями: KMnO4, K2Cr2O7 (tºC) , MnO2 (tºC),
- 46. Получение Br2 Промышленный – хлорирование рассолов, содержащих Br- (морская вода и вода некоторых озер) 2Br- +
- 47. Получение J2 Лабораторный способ (редко) MnO2 + 2J- + 4H+ = Mn2+ +2H2O + J2 (J2
- 48. Галеноводороды НХ В газовой фазе: Hδ+→Xδ- (полярная ковалентная связь) Дипольный момент: HF > HCl > HBr
- 49. Особенности HF HF (жидкий) – сильная кислота HF (газ) - сильная кислота HF (в воде) -
- 50. Получение HX А) Синтез из простых веществ H2 + X2 = 2 HX, ΔrH Для увеличения
- 51. Получение HX Б) Из солей реакцией ионного обмена CaF2(тв) + H2SO4 (конц) = CaSO4 + 2HF
- 52. Ox/red свойства HX
- 54. Скачать презентацию

![Инертные и лабильные комплексы [Fe(H2O)6]3+ и [Cr(H2O)6]3+ имеют близкие значения константы образования](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/947660/slide-2.jpg)
![[Ni(CN)4]2- β4 = 1022, термодинамически очень стабилен: C[Ni(CN)4]2- = CCN- = 1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/947660/slide-3.jpg)

![1. Реакция NiCl2 в воде с аммиаком (получение) [Ni(H2O)6]2+ + 6NH3 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/947660/slide-5.jpg)

































 Элементы таблицы Менделеева
Элементы таблицы Менделеева Степени окисления
Степени окисления Ионообменная хроматография в разделении белков
Ионообменная хроматография в разделении белков Когда образуется кислая соль?
Когда образуется кислая соль? Биогенный элемент. Кобальт (Со)
Биогенный элемент. Кобальт (Со) Степень окисления
Степень окисления Белки. Структуры белков
Белки. Структуры белков способы разделения смесей
способы разделения смесей Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Бешагина Владимира Викторовича
Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Бешагина Владимира Викторовича Презентация на тему Водородная связь (11 класс)
Презентация на тему Водородная связь (11 класс)  Соединения щелочноземельных металлов
Соединения щелочноземельных металлов Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  Жиры. Классификация жиров
Жиры. Классификация жиров Презентация на тему Таблица Менделеева и строение атома
Презентация на тему Таблица Менделеева и строение атома  Автомобильные бензины. Свойства топлив
Автомобильные бензины. Свойства топлив Алкины
Алкины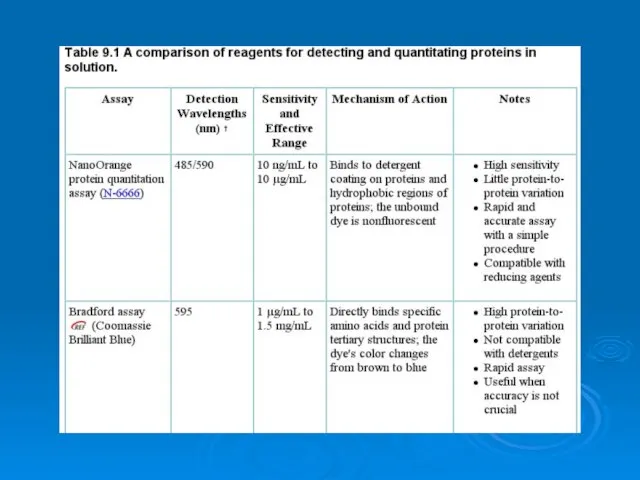 Analysis of proteins
Analysis of proteins Формулы оксидов
Формулы оксидов Химическая кинетика и равновесие
Химическая кинетика и равновесие Химическое ассорти
Химическое ассорти Презентация на тему Ферменты и гормоны
Презентация на тему Ферменты и гормоны  Аммиак
Аммиак Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова Презентация на тему Электролиты
Презентация на тему Электролиты  Бинарные соединения
Бинарные соединения Промышленное производство азотных удобрений
Промышленное производство азотных удобрений Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Коррозия металлов. Способы защиты от коррозии
Коррозия металлов. Способы защиты от коррозии