Слайд 2АММИАК – NH3
Аммиак (в европейских языках его название звучит как «аммониак») своим

названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак.
По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Слайд 3СТРОЕНИЕ МОЛЕКУЛЫ
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине.
Три
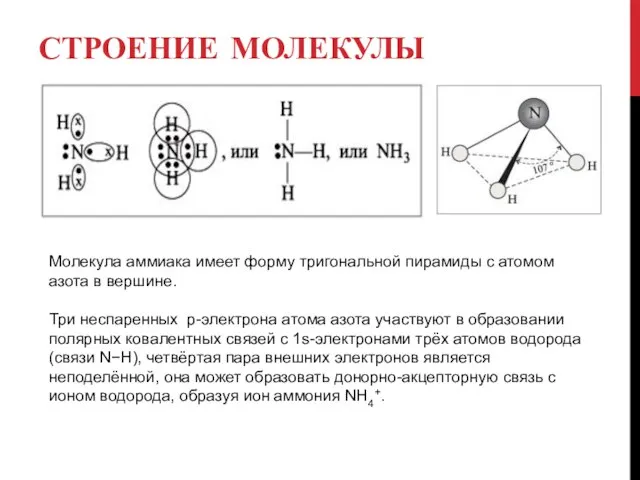
неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Слайд 4ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА
Бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти

вдвое легче воздуха, ядовит.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы.
Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
Слайд 5ПОЛУЧЕНИЕ АММИАКА
В лаборатории
Для получения аммиака в лаборатории используют действие сильных щелочей на

соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O
(NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O
Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O
При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха
В промышленности
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Условия:
Кат-р –железо
t = 450 – 500 ˚С
P = 25 – 30 МПа
Слайд 6ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
NH3 – сильный восстановитель.
1. Горение аммиака (при нагревании)
4NH3 + 3O2

→ 2N2 + 6H20
2. Каталитическое окисление амииака (кат. Pt – Rh, t)
4NH3 + 5O2 → 4NO + 6H2O
3. с оксидами металлов
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O
4. с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
5. аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N2 + 3H2
Слайд 7ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
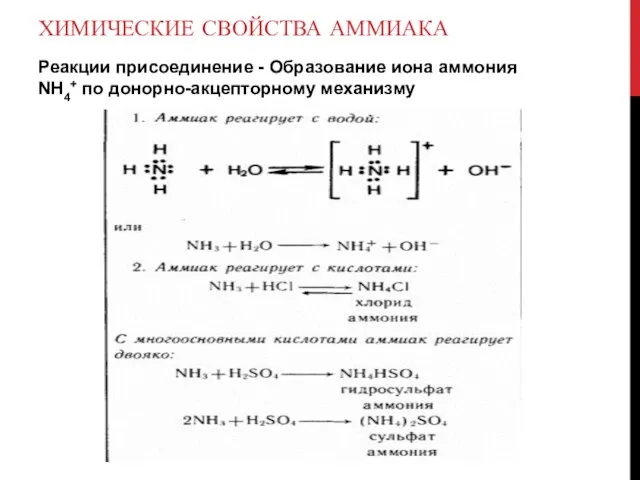
Реакции присоединение - Образование иона аммония NH4+ по донорно-акцепторному механизму






 Презентация на тему Жиры (9 класс)
Презентация на тему Жиры (9 класс)  Химические структуры
Химические структуры Общая характеристика металлов
Общая характеристика металлов Презентация на тему Обобщение: предельные и непредельные углеводороды
Презентация на тему Обобщение: предельные и непредельные углеводороды  Тест 1 задание
Тест 1 задание Химические уравнения
Химические уравнения Химические связи и взаимное влияние атомов в органических соединениях
Химические связи и взаимное влияние атомов в органических соединениях Які існують способи розділення сумішей?
Які існують способи розділення сумішей? Физическая химия поверхностных явлений
Физическая химия поверхностных явлений Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основной государственный экзамен. Химия 2021. Задание 14
Основной государственный экзамен. Химия 2021. Задание 14 Общие способы получения металлов
Общие способы получения металлов Гидролиз солей
Гидролиз солей Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ 60d677dc87dcd9320c87dd4e7b80d6ac
60d677dc87dcd9320c87dd4e7b80d6ac Презентация на тему Природные источники углеводородов и их переработка
Презентация на тему Природные источники углеводородов и их переработка  Полимеры
Полимеры Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Классификация органических веществ
Классификация органических веществ Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Основной закон радиоактивного распада и активность радионуклидов
Основной закон радиоактивного распада и активность радионуклидов Презентация на тему Полимеры. Каучуки. Резина
Презентация на тему Полимеры. Каучуки. Резина  Обобщение знаний об углеводородах
Обобщение знаний об углеводородах Занимательная химия в 8 классе
Занимательная химия в 8 классе Строение металлов и их сплавов
Строение металлов и их сплавов Предельные одноатомные спирты
Предельные одноатомные спирты Презентация на тему Этиловый спирт и его влияние на здоровье человека
Презентация на тему Этиловый спирт и его влияние на здоровье человека  Газовые смеси. Способы задания газовых смесей. Лекция 5
Газовые смеси. Способы задания газовых смесей. Лекция 5