Слайд 2Пример 9
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го

раствора брома.
Слайд 31.Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая,

что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4
Слайд 42.Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего

с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль.
Слайд 53.Так как количество брома, вступившего в реакцию, в 2 раза больше, чем

алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01
СnH2n−2 + 2Br2 → СnH2n−2Br4
Слайд 64.Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
5.Находим формулу

алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.
Это пентадиен С5Н8.
Ответ: C5H8
Слайд 7Пример 10
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился

водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Слайд 8Решение примера 10
1.Формула предельного одноатомного спирта — CnH2n+1OH.
Здесь удобно записывать спирт

в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
Слайд 92.Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na → 2CnH2n+1ONa
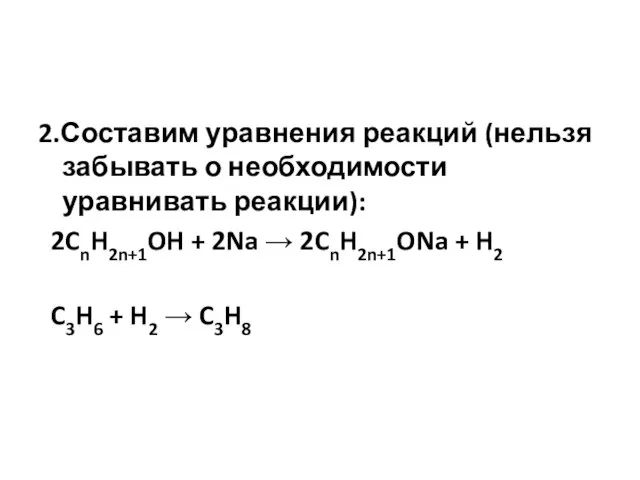
+ H2
C3H6 + H2 → C3H8
Слайд 103. Можно найти количество пропена, а по нему — количество водорода. Зная

количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль.
Слайд 114. Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74

/ 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.
Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
Слайд 12Пример 11
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38

г спирта и 1,8 г одноосновной карбоновой кислоты.
Слайд 13Решение примера 11
1.Общую формулу сложного эфира, состоящего из спирта и кислоты с

разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH
Слайд 142. Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма

масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 моль
Слайд 153. Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их

молярные массы:
Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.
Слайд 164.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46

= 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
Слайд 17Пример 12
Определить формулу аминокислоты, если при действии на 8,9 г её избытком

гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Слайд 18Решение примера 12.
Общая формула аминокислоты (если считать, что она не содержит никаких

других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно.
Слайд 19Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa +

H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции.
Слайд 20Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли

через молярные массы и приравнять их:
M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15
Легко увидеть, что R = CH3.
Слайд 21Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 =

15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
Слайд 22Источники
http://ege-study.ru/materialy-ege/ximiya-chast-s-zadacha-s5-opredelenie-formul-organicheskix-veshhestv/






















 Вводный урок по химии
Вводный урок по химии Электролиз (катод)
Электролиз (катод) Средства для борьбы с бытовыми насекомыми
Средства для борьбы с бытовыми насекомыми Презентация на тему Галогены в организме человека
Презентация на тему Галогены в организме человека  Амины. Классификация аминов
Амины. Классификация аминов Свойства жидкостей
Свойства жидкостей Презентация на тему Роль химии в жизни общества
Презентация на тему Роль химии в жизни общества  20141013_dragotsennye_kamni_yuzhnogo_urala
20141013_dragotsennye_kamni_yuzhnogo_urala Ацетиленди гидратациялау
Ацетиленди гидратациялау Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции Лайфхаки на кухне
Лайфхаки на кухне Метаболизм азота
Метаболизм азота Свойства черных и цветных металлов
Свойства черных и цветных металлов Строение атома
Строение атома Ионная химическая связь
Ионная химическая связь Пищевая сода
Пищевая сода Электролиз. Задания
Электролиз. Задания Положение металлов в периодической системе химических элементов
Положение металлов в периодической системе химических элементов Буферлік жүйелер мен ерітінділер туралы түсініктер, олардың құрамы және жіктелуі
Буферлік жүйелер мен ерітінділер туралы түсініктер, олардың құрамы және жіктелуі Дзержинский политехнический институт. Отчет о работе химической школы
Дзержинский политехнический институт. Отчет о работе химической школы Буферные системы
Буферные системы Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Плазменное состояние вещества
Плазменное состояние вещества Щелочные металлы
Щелочные металлы Степени окисления химических элементов в соединениях
Степени окисления химических элементов в соединениях Химическая промышленность и химические технологии
Химическая промышленность и химические технологии ВКР: Определение показателей качества мясной и колбасной продукции различных производителей
ВКР: Определение показателей качества мясной и колбасной продукции различных производителей Природные источники углеводородов
Природные источники углеводородов