Слайд 2При помощи термодинамики устанавливается лишь принципиальная возможность или невозможность протекания процессов в

заданном направлении.
Химическая термодинамика позволяет решить вопрос о направлении протекания химических реакций и оценить предельно достижимые (равновесные) состояния реакционной системы.
Однако она не может ответить на вопросы, имеющие чрезвычайно важное практическое значение в химической технологии: как быстро произойдет химическое превращение, за какой промежуток времени будет получено то или иное количество продукта реакции.
Слайд 3Решающее значение при выборе условий проведения химико-технологических процессов имеют вопросы скорости химических

превращений, изучаемые химической кинетикой.
Для химической технологии важен конечный результат кинетических исследований — конкретный вид уравнения, позволяющего рассчитывать скорость химической реакции при различных условиях ее проведения. Кинетические уравнения, содержащие необходимую информацию об основных закономерностях химических превращений, являются первоосновой математической модели химического реактора. Без знания кинетических закономерностей невозможно правильно выбрать тип реактора и рассчитать его конструктивные размеры.
Слайд 4Кинетика гомогенных реакций
Скорости химических реакций обычно определяются эмпирически (экспериментально) и зависят от

многих факторов, в том числе механизма процесса (любой процесс протекает в одну или несколько стадий, для каждой из которых имеется своя скорость реакции), наличия катализаторов (катализаторы снижают энергетический барьер преодоления так называемого «переходного состояния») и др.
Скорость химической реакции определяется количеством прореагировавшего исходного вещества или количеством полученного целевого продукта в единицу времени в единице объема системы.
Слайд 8Что же является «движущей силой» химических реакций, почему они происходят и почему

они прекращаются, достигнув определенного результата?
Химики назвали силу, вызывающую химические реакции, сродством реакции. Все химические реакции вынуждают систему двигаться к состоянию равновесия, в котором суммарное сродство реакции обращается в нуль. Если химическое сродство отлично от нуля, то система не находится в термодинамическом равновесии и химические реакции продолжаются, вынуждая систему переходить в равновесное состояние.
Слайд 11Принимая во внимание, что величины химического сродства связаны с константой равновесия получается,

что:
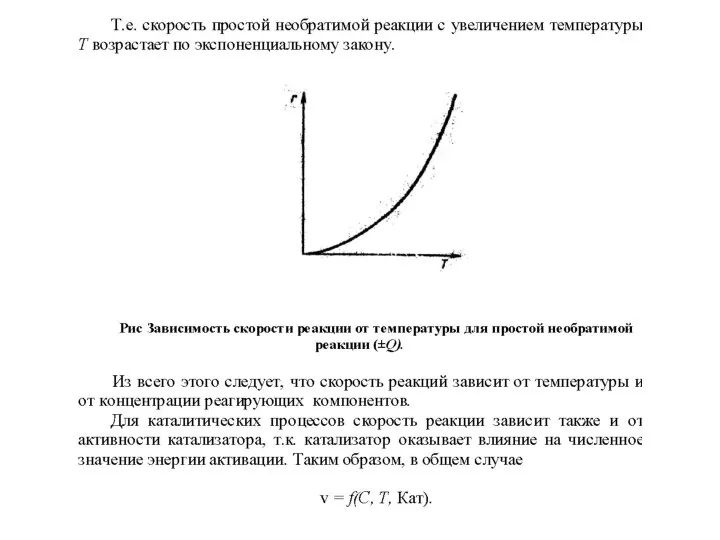
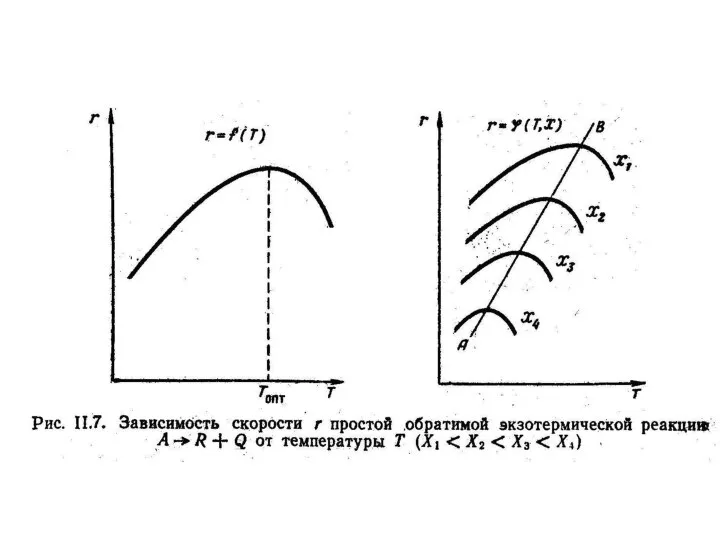
для экзотермических реакций с повышением температуры суммарная скорость реакции с одной стороны должна возрастать за счет увеличения степени экспоненты, а с другой стороны снижаться, так как для экзотермических реакций константа равновесия уменьшается при повышении температуре. В связи с этим при повышении температуры скорость реакции вначале увеличивается, достигает максимального значения, а затем снижается. Таким образом, зависимость v =f(T) проходит через максимум (рис. II. 7).









 Вермикулитовый концентрат
Вермикулитовый концентрат Неметаллы. Контрольная работа. 9 класс
Неметаллы. Контрольная работа. 9 класс Кроссворд Интересные факты в химии
Кроссворд Интересные факты в химии Применение хидких кристалов в промышленности
Применение хидких кристалов в промышленности Презентация на тему Артур Конан-Дойл «Собака Баскервилей»
Презентация на тему Артур Конан-Дойл «Собака Баскервилей»  Соединения алюминия
Соединения алюминия Соли и их свойства
Соли и их свойства Неметаллы. 11 класс
Неметаллы. 11 класс Альдегиды. Кетоны
Альдегиды. Кетоны Л1.4. Диаграмма железо-углерод
Л1.4. Диаграмма железо-углерод Плазменное состояние вещества
Плазменное состояние вещества Радиоактивные изотопы
Радиоактивные изотопы Пути использования активной уксусной кислоты
Пути использования активной уксусной кислоты Карбоновые кислоты
Карбоновые кислоты gidroliz_soley (1)
gidroliz_soley (1) Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Капиллярное поднятие жидкости
Капиллярное поднятие жидкости Презентация на тему Химия наука о веществах и их превращениях
Презентация на тему Химия наука о веществах и их превращениях  Карбонильные Соединения. Альдегиды и кетоны
Карбонильные Соединения. Альдегиды и кетоны Презентация на тему Благородные газы
Презентация на тему Благородные газы  Диффузия золота и свинца
Диффузия золота и свинца Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1)
Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1) Минерал дунит
Минерал дунит Вода знакомая и не знакомая
Вода знакомая и не знакомая Химические реакции. Классификация
Химические реакции. Классификация Тема урока: «Свойства тканей из химических волокон»
Тема урока: «Свойства тканей из химических волокон» Обобщение темы «Неметаллы» (Подгруппа азота)
Обобщение темы «Неметаллы» (Подгруппа азота) Тренажер - Валентность. 8 класс
Тренажер - Валентность. 8 класс