Содержание
- 2. Получение галогенов. Биологическое значение и применение галогенов и их соединений
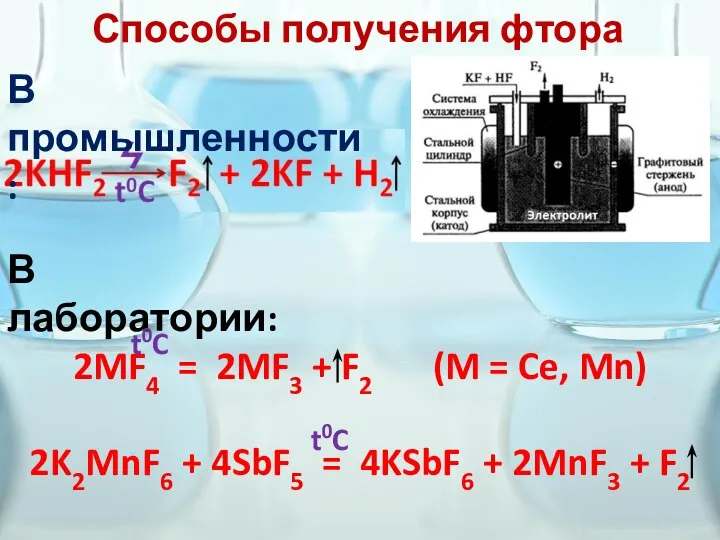
- 3. Способы получения фтора В промышленности: В лаборатории: 2MF4 = 2MF3 + F2 (M = Ce, Mn)
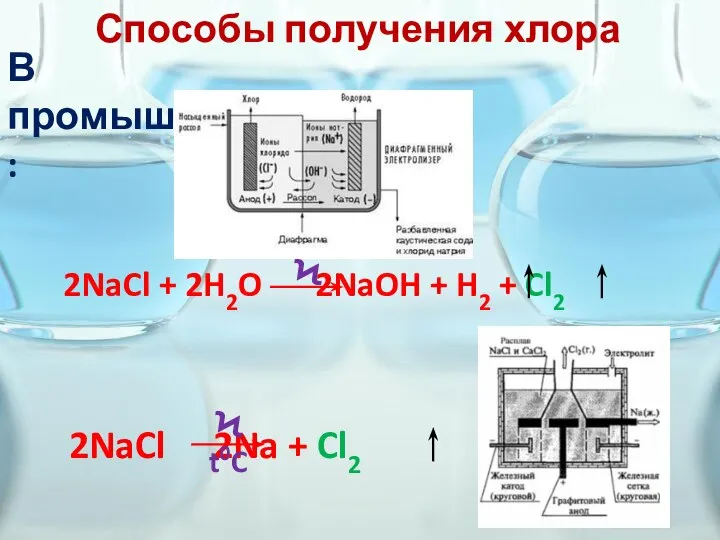
- 4. Способы получения хлора В промышленности: 2NaCl + 2H2O 2NaOH + H2 + Cl2 Ϟ 2NaCl 2Na
- 5. В лаборатории: 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O 16HCl + 2KMnO4 = 2KCl
- 6. Способы получения брома В промышленности: 2NaBr + Cl2 = 2NaCl + Br2 В лаборатории: 2NaBr +
- 7. Способы получения иода В промышленности: 2NaI + Cl2 = 2NaCl + I2 2NaIO3 + 5SO2 +
- 8. Применение фтора F2 Тефлоны Фреоны Разработка заменителей крови Окислитель ракетного топлива Фториды в зубных пастах
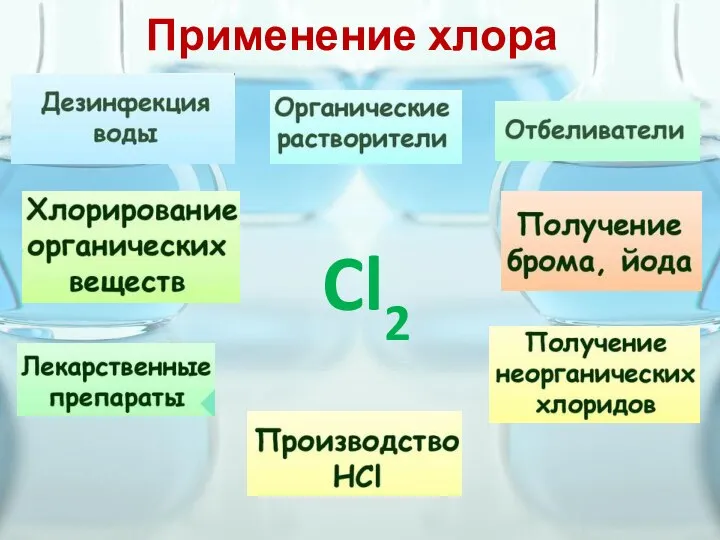
- 9. Применение хлора Cl2
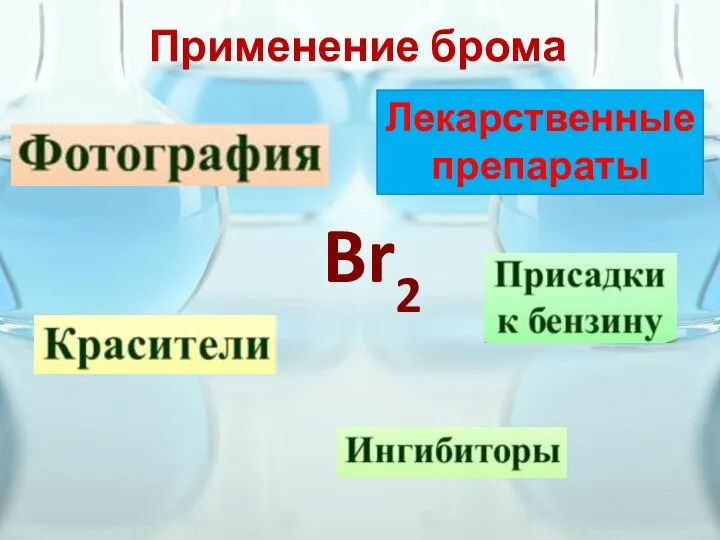
- 10. Применение брома Br2 Лекарственные препараты
- 12. Скачать презентацию





 Презентация на тему Алмазы Индии
Презентация на тему Алмазы Индии  Азот
Азот Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Sinteticheskie_Materialy_I_Ikh_Rol_1
Sinteticheskie_Materialy_I_Ikh_Rol_1 Теория гидродинамического подобия
Теория гидродинамического подобия Химия һәм сәламәт яшәү рәвеше
Химия һәм сәламәт яшәү рәвеше Реакции ионного обмена, гидролиз солей
Реакции ионного обмена, гидролиз солей Что такое кислота? Составляем общую формулу
Что такое кислота? Составляем общую формулу Физико-химия дисперсных систем
Физико-химия дисперсных систем Презентация на тему Предмет химии Вещества
Презентация на тему Предмет химии Вещества  Химические знания - в жизнь. Основы нутрициологии
Химические знания - в жизнь. Основы нутрициологии Контроль качества лекарственных средств, производных аминокислот ароматического ряда. Лекция № 11
Контроль качества лекарственных средств, производных аминокислот ароматического ряда. Лекция № 11 Вдоль по радуге
Вдоль по радуге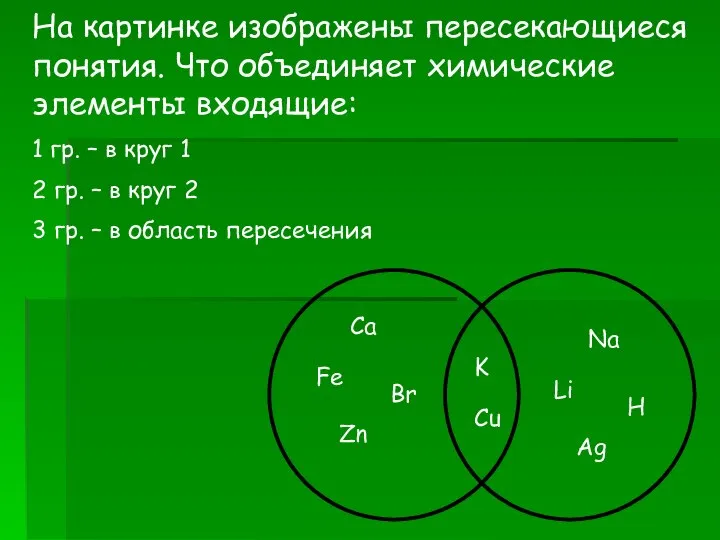 Задачи. Химические элементы
Задачи. Химические элементы Алкадиены. Строение. Изомерия. Свойства
Алкадиены. Строение. Изомерия. Свойства Сахароза
Сахароза Ионные уравнения
Ионные уравнения Презентация на тему Теория электролитической диссоциации.
Презентация на тему Теория электролитической диссоциации.  ЭОР в преподавании химии
ЭОР в преподавании химии Химия. Контроль знаний
Химия. Контроль знаний Олово и оловоорганические соединения, их свойства и применение
Олово и оловоорганические соединения, их свойства и применение Белки́ (протеины, полипепти́ды)
Белки́ (протеины, полипепти́ды) Химическое равновесие
Химическое равновесие Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Значимые личности в химии
Значимые личности в химии Число химических связей, способных образовать данный атом
Число химических связей, способных образовать данный атом Типы химических реакций
Типы химических реакций Воздух
Воздух