Содержание
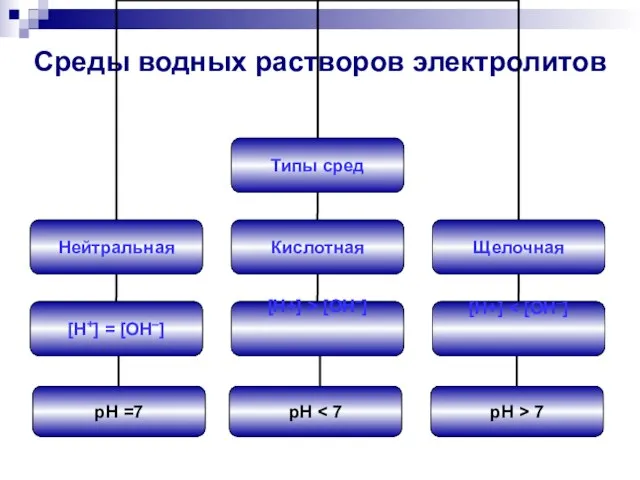
- 3. Среды водных растворов электролитов pH =7 pH pH > 7
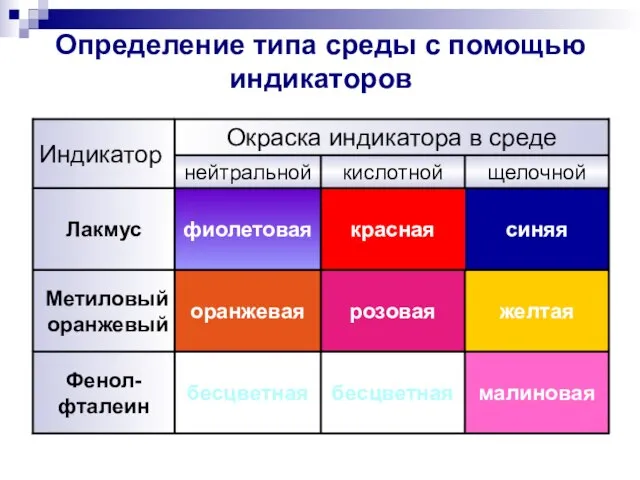
- 4. Определение типа среды с помощью индикаторов синяя красная фиолетовая Лакмус малиновая бесцветная бесцветная Фенол- фталеин желтая
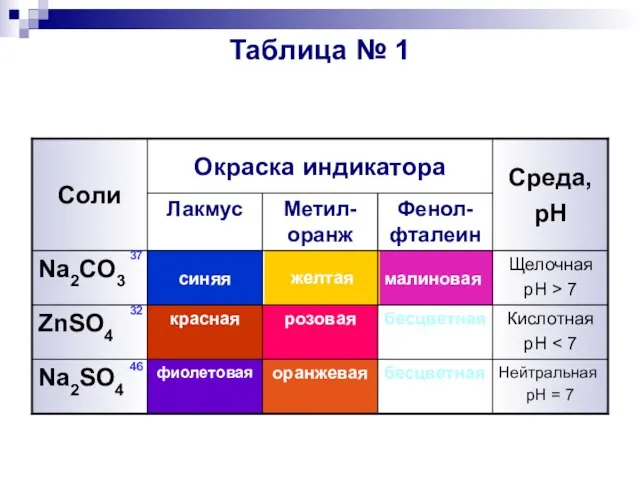
- 5. Таблица № 1 Нейтральная pH = 7 бесцветная оранжевая фиолетовая Na2SO4 Кислотная pH бесцветная розовая красная
- 6. Что такое гидролиз? Гидролиз (от греческого hydro – вода; lysis – разложение)
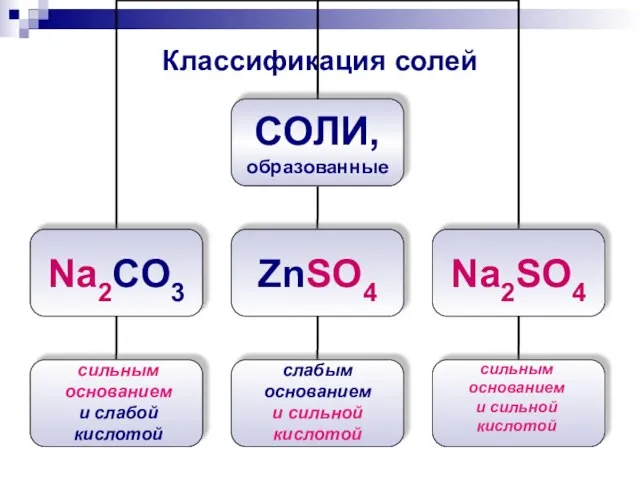
- 7. Классификация солей сильным основанием и слабой кислотой слабым основанием и сильной кислотой сильным основанием и сильной
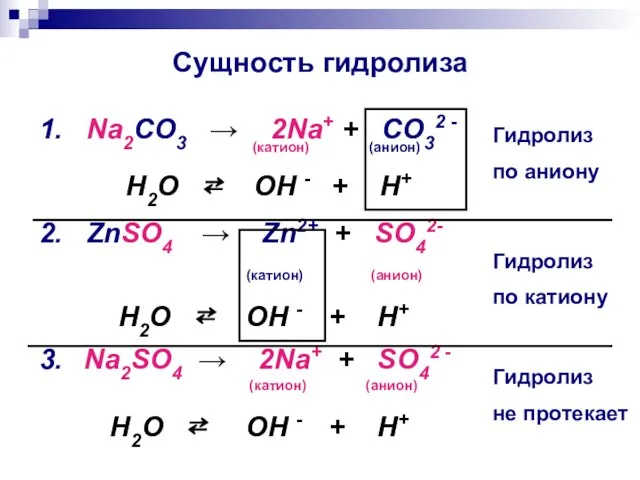
- 8. Сущность гидролиза 1. Na2CO3 → 2Na+ + CO32 - (катион) (анион) H2O ⇄ OH - +
- 9. Определение гидролиза Гидролиз соли – это химическая реакция обмена соли с водой, в результате которой ионы
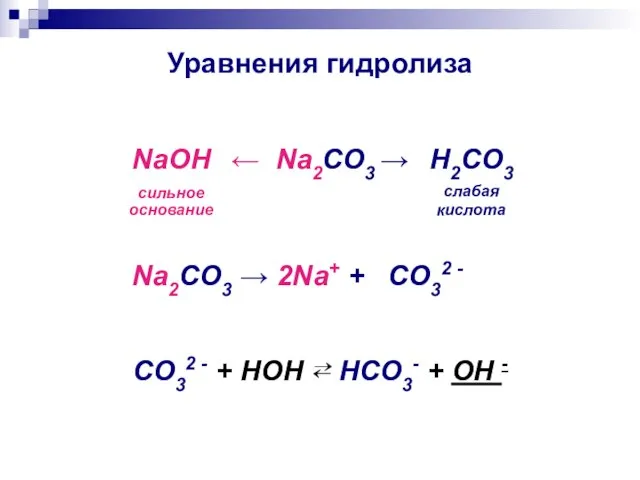
- 10. Уравнения гидролиза ← Na2CO3 → NaOH сильное основание H2CO3 слабая кислота Na2CO3 → 2Na+ + CO32
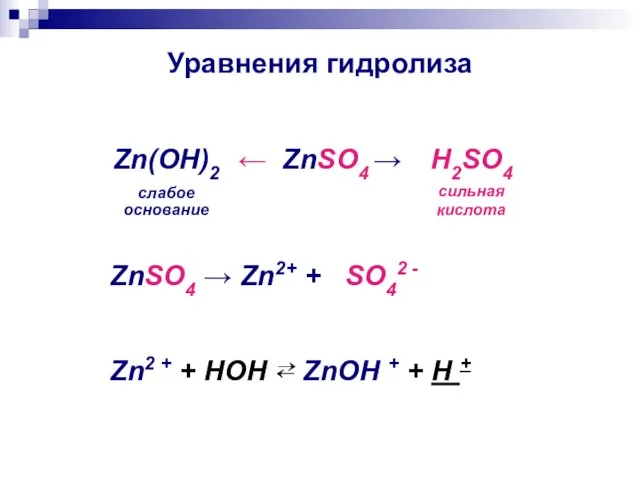
- 11. Уравнения гидролиза ← ZnSO4 → Zn(ОН)2 слабое основание H2SO4 сильная кислота ZnSO4 → Zn2+ + SO42
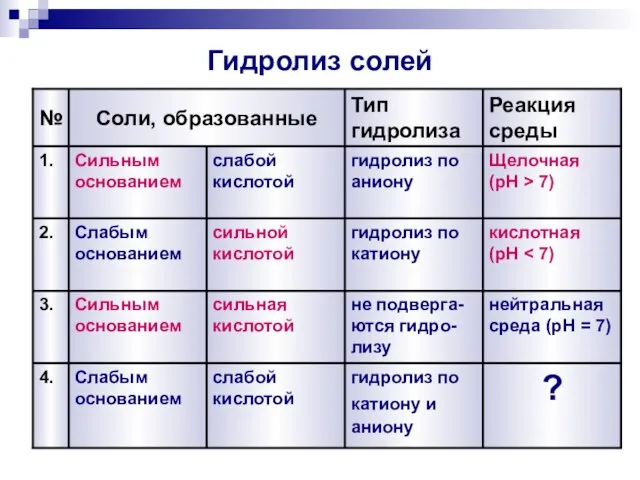
- 12. Гидролиз солей 3. 2. 1. № Реакция среды, pH Тип гидролиза Соли, образованные нейтральная среда (pH
- 13. Задание. Определите реакцию среды водных растворов солей. Таблица № 2 NaNO3 K2S Na2SiO3 5. NH4NO3 LiNO3
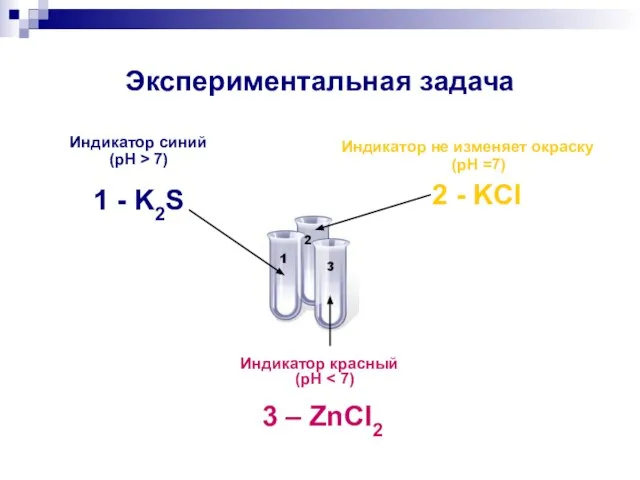
- 14. Экспериментальная задача В трех пронумерованных пробирках даны растворы солей: ZnCl2, K2S, KCl. а) Исследуйте каждый из
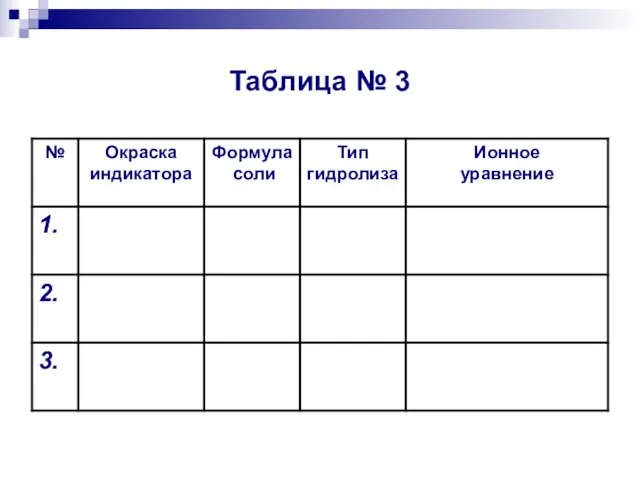
- 15. Таблица № 3
- 16. Экспериментальная задача Индикатор синий (pH > 7) 1 - K2S Индикатор не изменяет окраску (pH =7)
- 17. Гидролиз солей 4. 3. 2. 1. № Реакция среды Тип гидролиза Соли, образованные ? гидролиз по
- 19. Скачать презентацию






 Обнаружение крахмала
Обнаружение крахмала Характеристика кислорода и серы
Характеристика кислорода и серы Железо и его соединения
Железо и его соединения Карбоновые кислоты
Карбоновые кислоты Гидролиз солей
Гидролиз солей α-Аминокислоты. Биологически важные реакции α-аминокислот. Строение пептидов и белков (Лекция 26)
α-Аминокислоты. Биологически важные реакции α-аминокислот. Строение пептидов и белков (Лекция 26) Алюминий
Алюминий Классификация органических соединений и реакций. Изомерия. Лекция 2
Классификация органических соединений и реакций. Изомерия. Лекция 2 Физическая химия
Физическая химия Синтетический каучук
Синтетический каучук Презентация на тему Полимеры и их получение
Презентация на тему Полимеры и их получение  Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Взаимодействие кислот с металлами. Кислоты-окислители
Взаимодействие кислот с металлами. Кислоты-окислители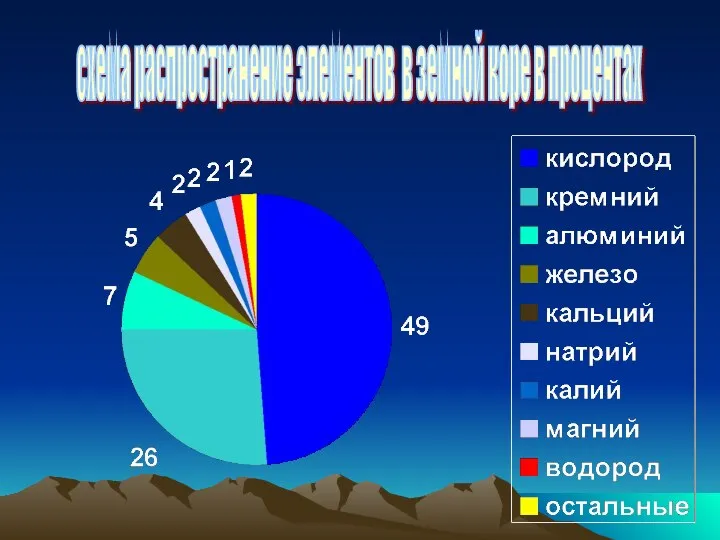 Схема распространение элементов в земной коре в процентах
Схема распространение элементов в земной коре в процентах Алюминий
Алюминий Серная кислота и её соли. Качественная реакция на сульфат-ион
Серная кислота и её соли. Качественная реакция на сульфат-ион Обобщение металлов
Обобщение металлов Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты Лекция 4 Строение атома
Лекция 4 Строение атома Ионизирующее излучение и окружающая среда
Ионизирующее излучение и окружающая среда Неметаллы в ПСХЭ
Неметаллы в ПСХЭ Введение. Основные понятия химии
Введение. Основные понятия химии Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Закон сохранения массы и химические уравнения
Закон сохранения массы и химические уравнения АРЕНЫ
АРЕНЫ Ароматические углеводороды. Бензол Презентация выполнена учителем химии лицея №1 пос. Львовский Подольского района Воробьёвой
Ароматические углеводороды. Бензол Презентация выполнена учителем химии лицея №1 пос. Львовский Подольского района Воробьёвой Занимательная химия в 8 классе
Занимательная химия в 8 классе Презентация на тему Элементы таблицы Менделеева
Презентация на тему Элементы таблицы Менделеева