Содержание
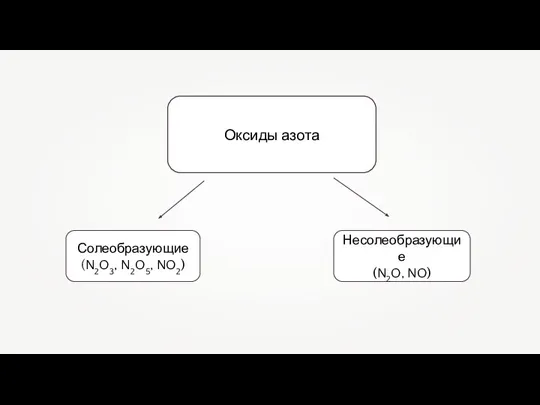
- 2. Оксиды азота
- 3. N2O3 + Н2О = 2HNO2 N2O5 + Н2О = 2HNO3 2NO2 + Н2О = HNO3 +
- 4. 2NO + О2 = 2NO2
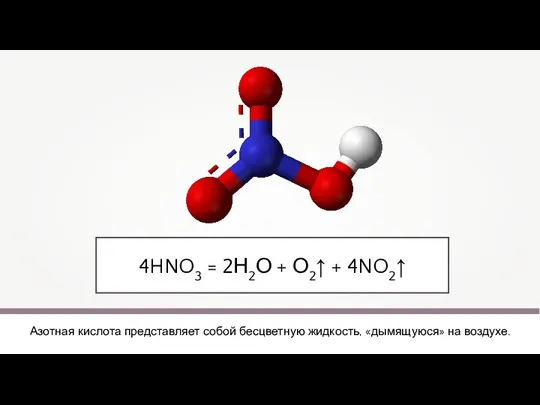
- 5. 4HNO3 = 2Н2О + О2↑ + 4NO2↑
- 6. 2HNO3 + СаО = Са(NO3)2 + Н2О Химические свойства азотной кислоты Взаимодействует с основными оксидами: Взаимодействует
- 7. При взаимодействии азотной кислоты с металлами не выделяется водород. Продукт реакции зависит от нескольких факторов: положения
- 10. Применение азотной кислоты: – производство минеральных азотных удобрений; – производство искусственных волокон; – производство пластических масс;
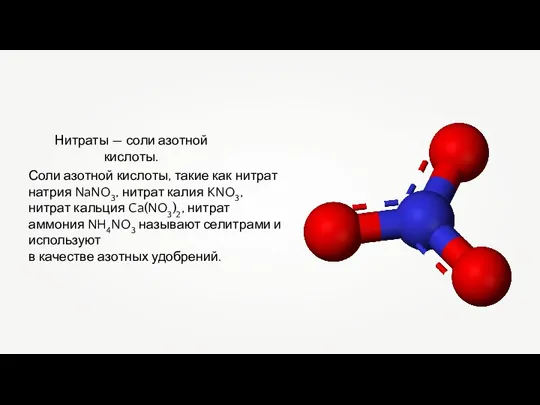
- 11. Нитраты — соли азотной кислоты. Соли азотной кислоты, такие как нитрат натрия NaNO3, нитрат калия KNO3,
- 12. KNO3 используют при изготовлении чёрного пороха. NH4NO3 применяют в изготовлении аммонала. AgNO3 используют в медицине в
- 15. Скачать презентацию







 Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5)
Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5) Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Основания. Определение. Формулы
Основания. Определение. Формулы Теория строения органических соединений
Теория строения органических соединений Презентация по Химии "Белки как основа всего живого"
Презентация по Химии "Белки как основа всего живого"  хим связь
хим связь Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Коррозия металлов, сплавов
Коррозия металлов, сплавов Производство серной кислоты
Производство серной кислоты Приготовление и хранение индикаторов для исследований
Приготовление и хранение индикаторов для исследований Алкины
Алкины Презентация на тему Вода – растворитель
Презентация на тему Вода – растворитель  Композитные материалы
Композитные материалы Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Презентация на тему Соединения азота
Презентация на тему Соединения азота  Презентация на тему Химия в разных науках
Презентация на тему Химия в разных науках  Типы химических реакций
Типы химических реакций bb85cf00b0d84614b17e8a6aa4be54a0
bb85cf00b0d84614b17e8a6aa4be54a0 Свойства неорганических веществ
Свойства неорганических веществ Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Metals Properties and compounds
Metals Properties and compounds Расчет по химическим уравнениям
Расчет по химическим уравнениям Характеристика высших гидроксидов по положению в ПСХЭ
Характеристика высших гидроксидов по положению в ПСХЭ Химические элементы
Химические элементы Металлы. Физические свойства металлов
Металлы. Физические свойства металлов Кремний и его соединения
Кремний и его соединения Практическое занятие: Решение задач. Классификация химических реакций
Практическое занятие: Решение задач. Классификация химических реакций Влияние растворителей на скорость органических реакций. (Лекция 10)
Влияние растворителей на скорость органических реакций. (Лекция 10)