Слайд 32 конкурс «Лаборант».
Лабораторная работа
Тема: Определение веществ.
Оборудование: растворы кислоты, основания, соли, пробирки, подставка

для пробирок, индикатор.
Ход работы:
Вывод: ______________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Слайд 43 конкурс «Уравняй».
H2 + CuO = Cu + H2O
СаО + Н2О =

Са(ОН)2
Са(ОН)2 = СаО + Н2О
Al + HCl = H2↑ + AlCl3
CaCl2 + Na2CO3 = CaCO3↓ + NaCl
CaBr2 + HF = CaF2↓ + HBr
H2 + O2 = H2O
Zn + CuCl2 = Cu + ZnCl2
NH3 = N2 + H2
Cu + S = CuS
AgF + NaCl = AgCl↓ + NaF
CaCO3 = CaO + CO2 ↑
CuBr2 + NaOH = Cu(OH)2↓ + NaBr
Fe + H2O = H2↑ + Fe2O3
Слайд 65 конкурс «Заполни таблицу».

Слайд 76 конкурс «Решение задач»
1.При восстановлении углем оксида Fe2O3 получили по 20 г

Fe. Сколько граммов оксида было взято?
2. При восстановлении углем оксидов SnO2 получили по 20 г Sn. Сколько граммов оксида было взято?






 Значимые личности в химии
Значимые личности в химии Простые вещества в стране Химляндии. 8 класс
Простые вещества в стране Химляндии. 8 класс Порядковый номер элемента. Изотопы
Порядковый номер элемента. Изотопы Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы
Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы Предмет органической химии. Особенности органических веществ
Предмет органической химии. Особенности органических веществ Соли, их классификация и свойства
Соли, их классификация и свойства Характеристика кислорода и серы
Характеристика кислорода и серы Уравнение состояния идеального газа
Уравнение состояния идеального газа Сухой метод определения глюкозы. Глюкометры
Сухой метод определения глюкозы. Глюкометры Презентация на тему Алюминий
Презентация на тему Алюминий  Изомерия и ее виды
Изомерия и ее виды Химическая связь
Химическая связь Кремний и его соединения
Кремний и его соединения Воздух
Воздух Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Основные понятия в химии
Основные понятия в химии Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Основы материаловедения. Раздел 1
Основы материаловедения. Раздел 1 Азот N2
Азот N2 Основи молекулярно-кінетичної теорії
Основи молекулярно-кінетичної теорії Гидролиз солей. Лекция №18
Гидролиз солей. Лекция №18 Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия
Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации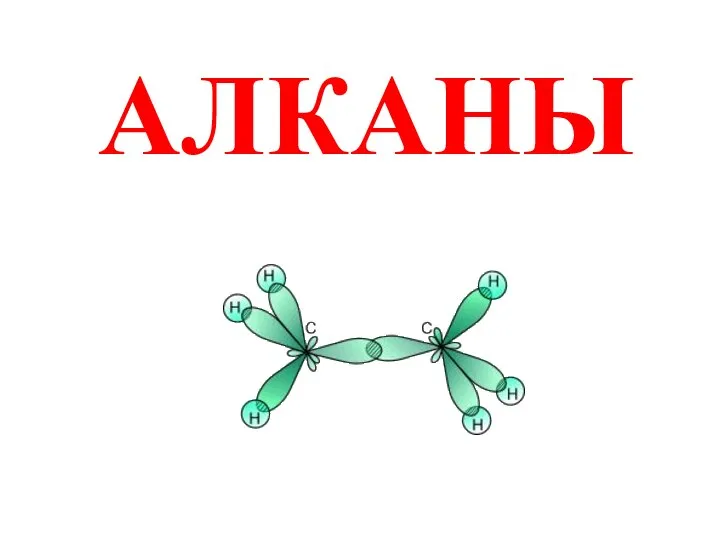 Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Презентация на тему Показатели воды - её жесткость и кислотность
Презентация на тему Показатели воды - её жесткость и кислотность