Слайд 2ЭТАПЫ УРОКА
I. Проверка домашнего задания. Фронтальный опрос.
II.Дидактическая игра «Классификация и номенклатура веществ».
III.Самостоятельная

работа.
IV.Подведение итогов.
Слайд 3ДОМАШНЕЕ ЗАДАНИЕ
1. С какими из перечисленных веществ:
KOH,HNO3,MgO,Cu,SiO2,Ca (OH)2- будет
реагировать серная

кислота?
2. Составьте уравнения реакций по схеме:
Fe2(SO4)3 Fe(ОН)3 Fe2О3 Fe2(SO4)3.
3. Решите задачу. К раствору, содержащему избыток хлорида железа(III), прилили раствор, содержащий 240 г гидроксида натрия. Определите массу и количество образовавшегося гидроксида железа(III).
Слайд 4КРИТЕРИИ ОЦЕНКИ ЗА ДОМАШНЕЕ ЗАДАНИЕ
1. Если задание выполнено самостоятельно и без ошибок,

поставьте -5 баллов.
2. Если допустили одну ошибку, поставьте
- 4 балла.
3. Если сделали две ошибки, поставьте
- 3 балла.
4. Если сделали три ошибки и более или не выполнили его, поставьте - прочерк.
Слайд 5ДИДАКТИЧЕСКАЯ ИГРА
«Найдите родственников и дайте им имена»
AI(OH)3, CO2, Mn2O7, HNO3, H2SiO3, Na2HPO4,

Mg(OH)2, CaCO3, RbOH, CuO, HBr, PbO2, KOH, Ca OHCI, H2SO3, NaHCO3, K3PO4 ,SO2, HgO, H2S, Zn(OH)2.
__________________________________________________________
1группа. Найти оксиды основные, кислотные, амфотерные (дать им названия)
2 группа. Найти основания растворимые и нерастворимые (дать им названия)
3 группа. Найти кислоты кислородсодержащие, бескислородные (дать им названия)
4 группа. Найти соли средние, основные, кислые (дать им названия)
Слайд 6ОТВЕТ ГРУППЫ №1
Основные оксиды
CuO – оксид меди (II)
HgO – оксид

ртути (II)
Кислотные оксиды
CO2- оксид углерода (IV)
Mn2O7- оксид марганца (VII)
SO2 – оксид серы (IV)
Амфотерные оксиды
PbO2- оксид свинца (IV)
Слайд 7ОТВЕТ ГРУППЫ №2
Растворимые основания
RbOH- гидроксид рубидия
KOH – гидроксид калия
Нерастворимые основания
AI(OH)3 – гидроксид

алюминия
Mg(OH)2- гидроксид магния
Zn(OH)2- гидроксид цинка
Слайд 8ОТВЕТ ГРУППЫ №3
Кислородсодержашие кислоты
HNO3- азотная кислота
H2SiO3- кремневая кислота
H2SO3 – сернистая кислота
Бескислородные кислоты
HBr-

бромоводородная кислота
H2S- сероводородная кислота
Слайд 9ОТВЕТ ГРУППЫ № 4
Средние соли
CaCO3 – карбонат кальция
K3PO4 – фосфат калия
Основные соли
Ca

OHCI – гидроксохлорид кальция
Кислые соли
Na2HPO4 – гидрофосфат натрия
NaHCO3 – гидрокарбонат натрия
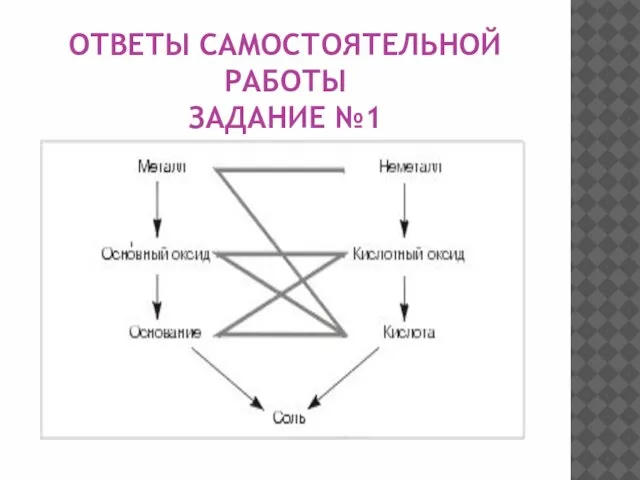
Слайд 10ОТВЕТЫ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
ЗАДАНИЕ №1
Слайд 11ЗАДАНИЕ №2
Zn + 2HCI = ZnCI2 + H2
2KOH + H2SO4 = K2SO4
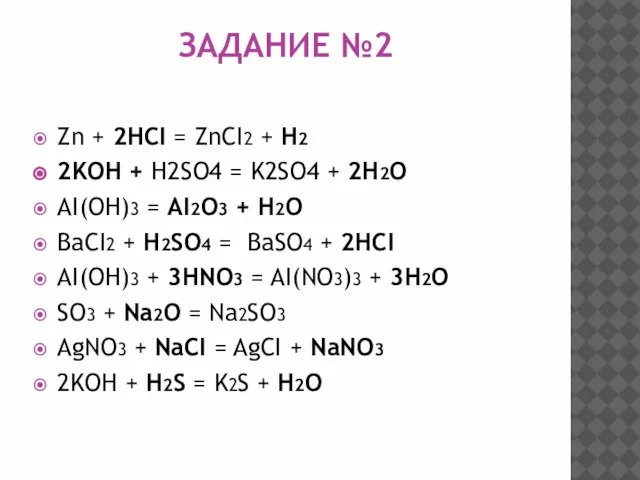
+ 2H2O
AI(OH)3 = AI2O3 + H2O
BaCI2 + H2SO4 = BaSO4 + 2HCI
AI(OH)3 + 3HNO3 = AI(NO3)3 + 3H2O
SO3 + Na2O = Na2SO3
AgNO3 + NaCI = AgCI + NaNO3
2KOH + H2S = K2S + H2O
Слайд 12ЗАДАНИЕ № 3
1) Ba -> BaO -> Ba(OH)2 ->BaCI2
(или другая

соль)
2) P -> P2O5 -> H3PO4 -> Na3PO4
Слайд 13КРИТЕРИИ ОЦЕНКИ ЗА ЗАДАНИЯ № 1,2,3
1. Если задание сделано без ошибок и

самостоятельно, поставьте- 5 баллов.
2. Если задание сделано без ошибок, но вы обращались за помощью к товарищу, поставьте -4 балла.
3. Если вы сделали одну или две ошибки, поставьте -3 балла.
4. Если сделали более двух ошибок или не справились с заданием, поставьте -прочерк.
Слайд 14ЗАДАНИЕ № 4
1) Лакмус + щелочь = синий окрас
2) FeCI3 + 3KOH

= 3KCI + Fe(OH)3
Слайд 15КРИТЕРИИ ОЦЕНКИ ЗА ЗАДАНИЕ №4
1. Если вы правильно определили раствор щелочи, самостоятельно

записали уравнения химической реакции получения гидроксида железа(III) в молекулярном и ионном видах, поставьте -5 баллов.
2. Если допустили одну ошибку в уравнении химической реакций, но лабораторный опыт провели правильно, поставьте -4 балла.
3. Если сделали две ошибки в уравнениях химических реакций и экспериментальная часть задания выполнена не совсем правильно, поставьте -3 балла.
4. Если не записаны уравнения химических реакций и не проделана экспериментальная часть задания, поставьте прочерк.
Слайд 16КРИТЕРИИ ВЫСТАВЛЕНИЯ ИТОГОВОЙ ОЦЕНКИ
1. Если все задания выполнены и большая часть с

оценкой «5», поставьте 5 баллов.
2. Если все задания выполнены, но преобладает оценка «4», поставьте 4 балла.
3. Если задания сделаны на оценку «3» или есть один прочерк, поставьте 3 балла.
4. Если вы не справились с двумя и более заданиями, поставьте прочерк.















 Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Оксиды и основания
Оксиды и основания Проверочный тест. Номенклатура алканов
Проверочный тест. Номенклатура алканов Фенол. Физические свойства
Фенол. Физические свойства Классификация неорганических соединений
Классификация неорганических соединений Презентация на тему Из чего сделаны северные трубопроводы
Презентация на тему Из чего сделаны северные трубопроводы  Синтез индолов по Неницеску
Синтез индолов по Неницеску Элементарный состав углей
Элементарный состав углей Виды металлов, сплавы металлов, применение в промышленности и в быту
Виды металлов, сплавы металлов, применение в промышленности и в быту Вода в природе
Вода в природе Teksta uzdevumi (1)
Teksta uzdevumi (1) Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Физические свойства
Физические свойства Презентация на тему Алхимики
Презентация на тему Алхимики  Основания и их свойства
Основания и их свойства Углеводы. Общие представления об углеводах
Углеводы. Общие представления об углеводах Свойства Н2
Свойства Н2 Презентация на тему Химические синонимы
Презентация на тему Химические синонимы  Диффузия в газах, жидкостях и твердых телах
Диффузия в газах, жидкостях и твердых телах Анилин как органическое основание
Анилин как органическое основание Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода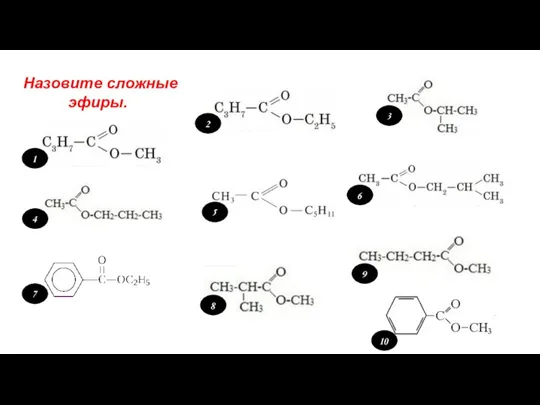 Cтроение жиров
Cтроение жиров Строение электронных оболочек атомов. 8 класс
Строение электронных оболочек атомов. 8 класс Хлор и хлороводород
Хлор и хлороводород Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Веселый химический КВН
Веселый химический КВН Карбоновые кислоты
Карбоновые кислоты