Содержание
- 2. Теории кислот и оснований Теория Аррениуса (1887-1889 гг.): кислота – нейтральная частица, диссоциирующая с образованием Н+;
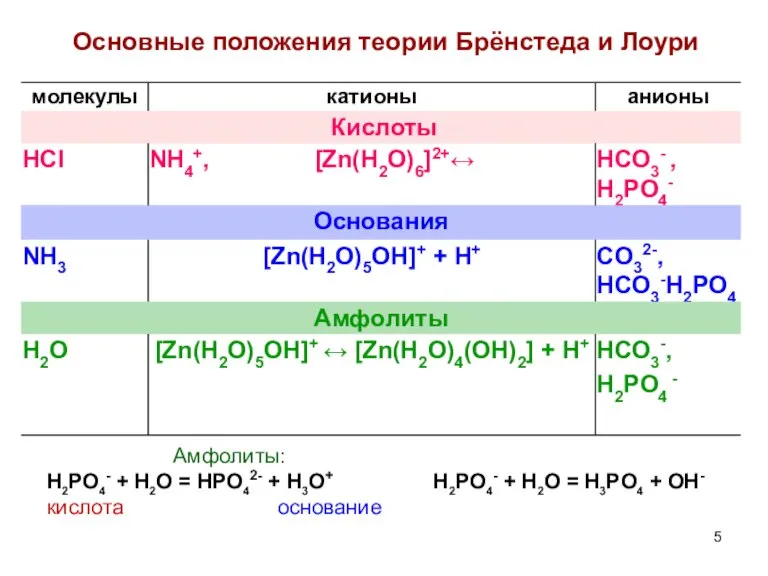
- 3. Основные положения теории Брёнстеда и Лоури 1. Кислота – донор протонов HA ↔ H+ + A-
- 4. Основные положения теории Брёнстеда и Лоури Каждой кислоте (основанию) соответствует сопряженное основание (кислота) HA + B
- 5. Основные положения теории Брёнстеда и Лоури Амфолиты: H2PO4- + H2O = HPO42- + H3O+ H2PO4- +
- 6. Классификация растворителей апротонные - бензол, гексан, CCl4 протогенные (кислотные) - HF б/в протофильные (основные) - кетоны
- 7. Автопротолиз SH + SH ↔ SH2+ + S- лионий лиат 2H2O ↔ H3O+ + OH- 2CH3COOH
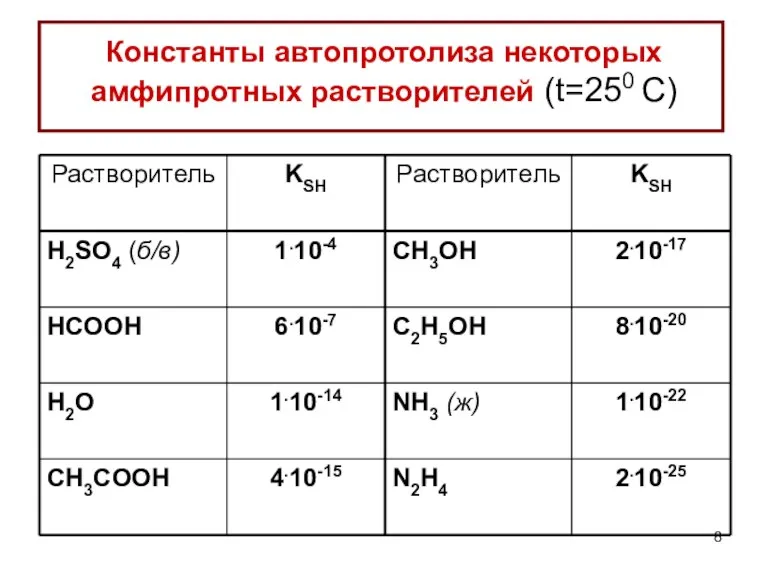
- 8. Константы автопротолиза некоторых амфипротных растворителей (t=250 C)
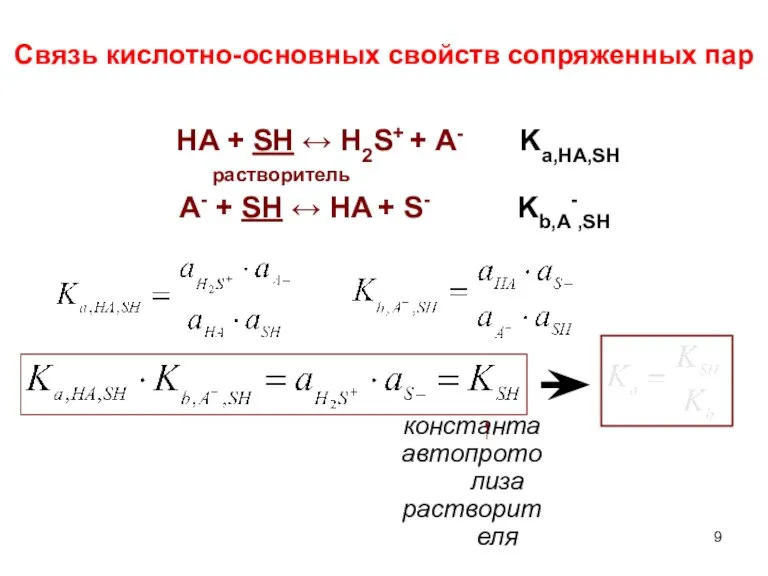
- 9. Связь кислотно-основных свойств сопряженных пар HA + SH ↔ H2S+ + A- растворитель A- + SH
- 10. Связь кислотно-основных свойств сопряженных пар Задача CH3COOH + H2O ↔ CH3COO- + H3O+
- 11. Кислота: HCO3- + H2O ↔ CO32- + H3O+ Задача Какие свойства преобладают у амфолита NaHCO3? Основание:
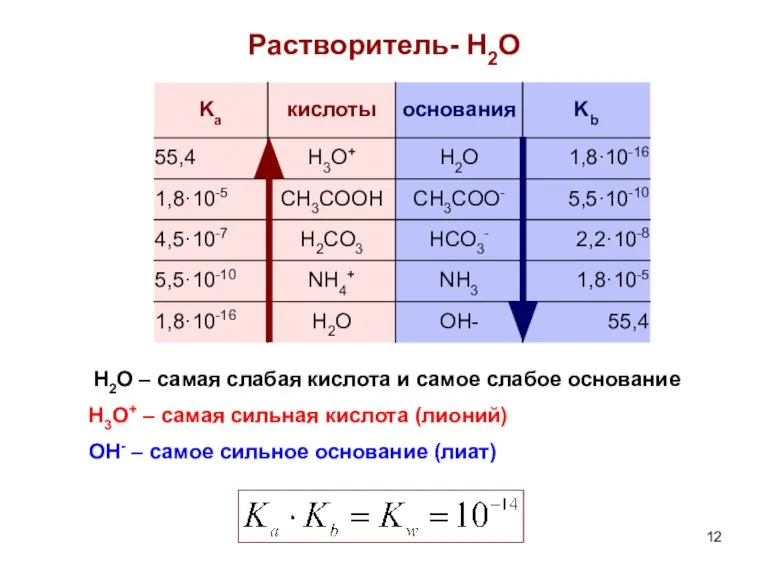
- 12. Растворитель- H2O H2O – самая слабая кислота и самое слабое основание H3O+ – самая сильная кислота
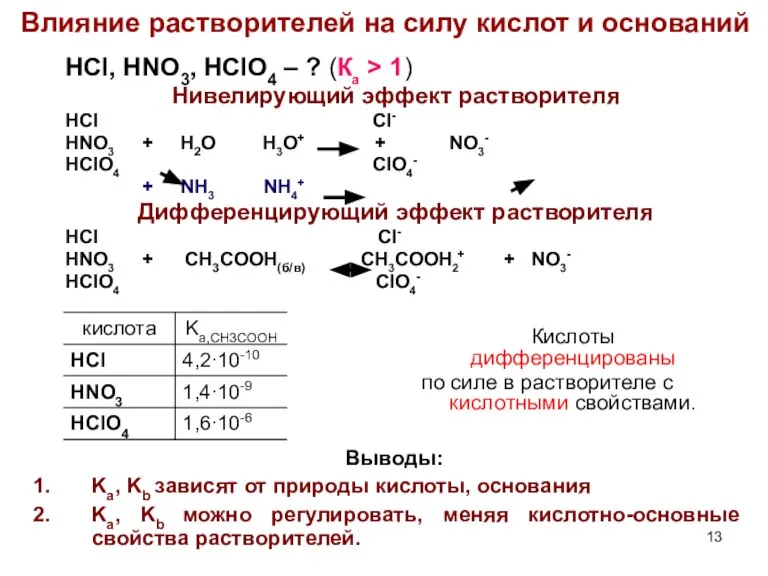
- 13. Влияние растворителей на силу кислот и оснований HCl, HNO3, HClO4 – ? (Ка > 1) Нивелирующий
- 14. Вычисление рН среды [H3O+] pH = - lg aH3O+ ≈ - lg [H3O+] (γH3O+ ≈ 1,
- 15. Вычисление рН среды 0,01 M раствор HCl → pH = 2 1·10-3 M раствор HCl →
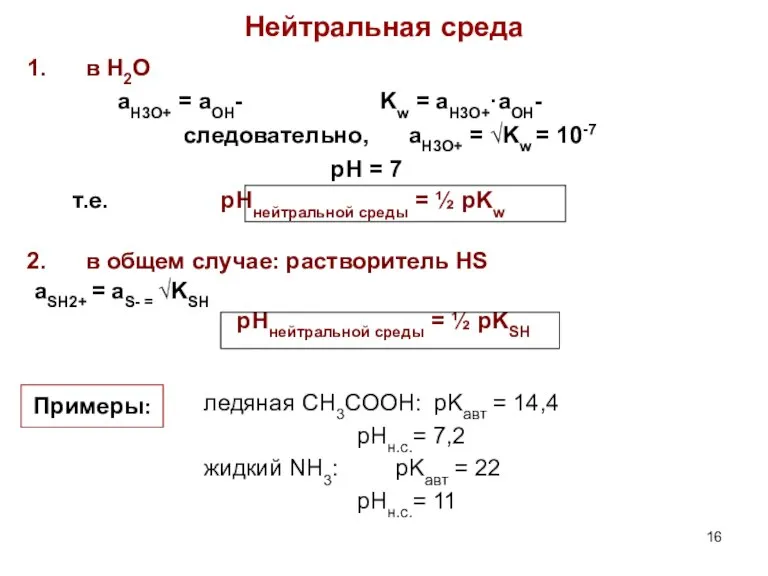
- 16. Нейтральная среда в H2O aH3O+ = aOH- Kw = aH3O+·aOH- следовательно, aH3O+ = √Kw = 10-7
- 17. Слабые протолиты 1. CH3COOH ↔ CH3COO- + H+ так как [CH3COOH] ≈ cCH3COOH В разбавленных растворах
- 18. Смесь слабых кислот (оснований) Принимаем, что степень диссоциации h
- 19. Амфолиты HA- + H2O ↔ H3O+ + A2- HA- + H2O ↔ H2A + OH- Вывод
- 20. Пример: Амфолит - NaHCO3 pH = 8,30
- 21. Буферные растворы CH3COOH + CH3COONa NH4Cl + NH3 NaHCO3 + Na2CO3 смесь слабой кислоты HA и
- 22. Кислотно-основное титрование
- 23. Кислотно-основное титрование HA + B ↔ HB+ + A- к.1 о.2 к.2 o.1 Рабочие растворы: HCl,
- 24. f – степень оттитрованности – отношение количества оттитрованного в данный момент вещества (nT) к исходному количеству
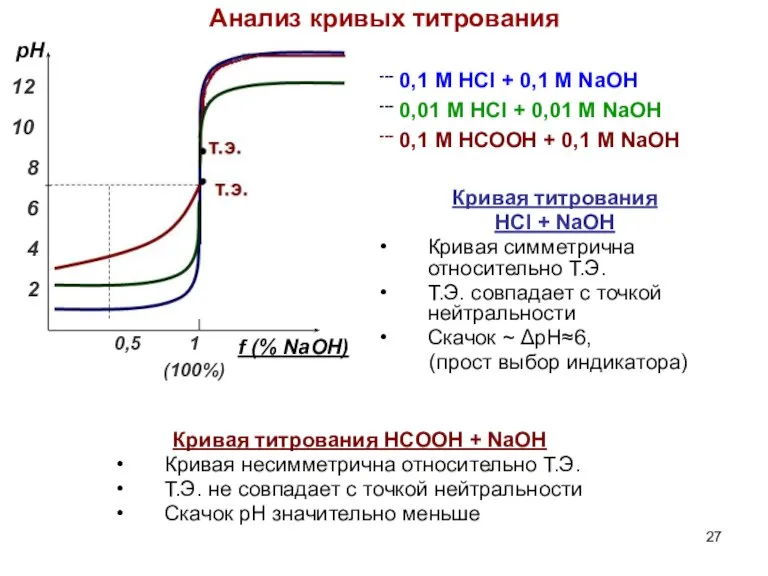
- 25. Титрование сильных кислот: 0,1 М HCl - 0,1 M NaOH f = 0,5 – 0,99:
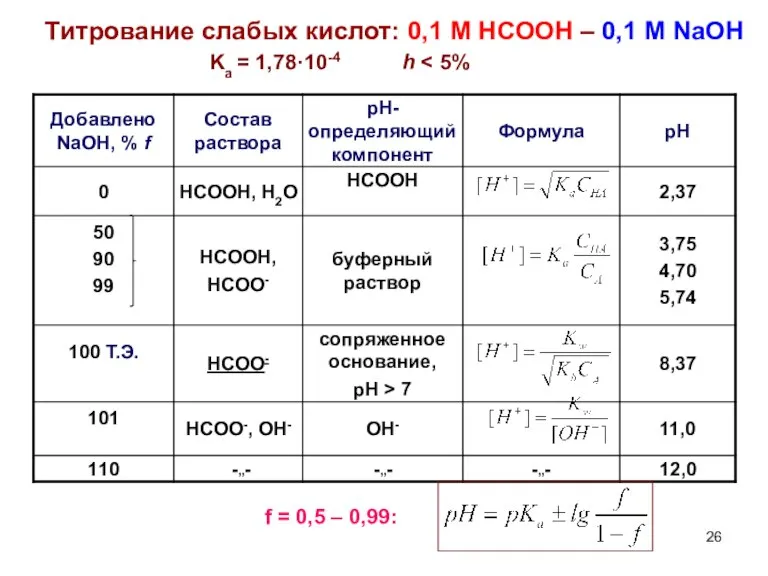
- 26. Титрование слабых кислот: 0,1 М НСООН – 0,1 М NaOH Ka = 1,78·10-4 h f =
- 27. --- 0,1 М HCl + 0,1 M NaOH --- 0,01 М HCl + 0,01 M NaOH
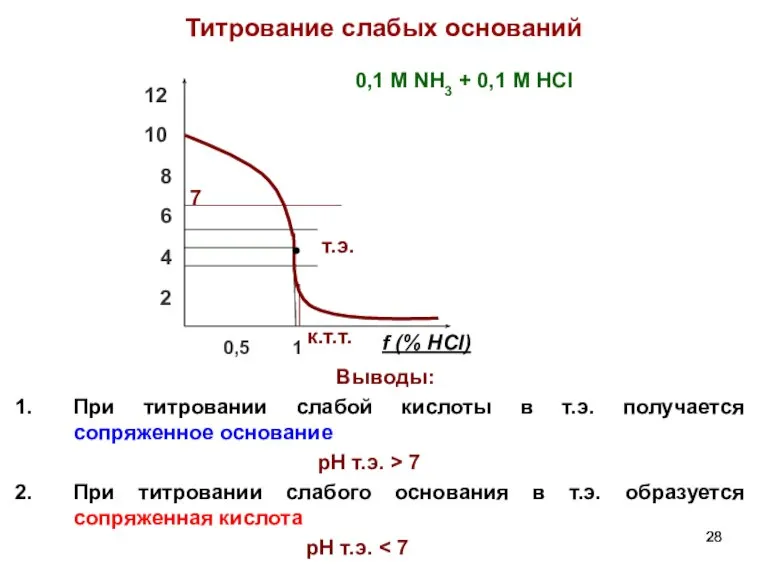
- 28. Титрование слабых оснований Выводы: При титровании слабой кислоты в т.э. получается сопряженное основание pH т.э. >
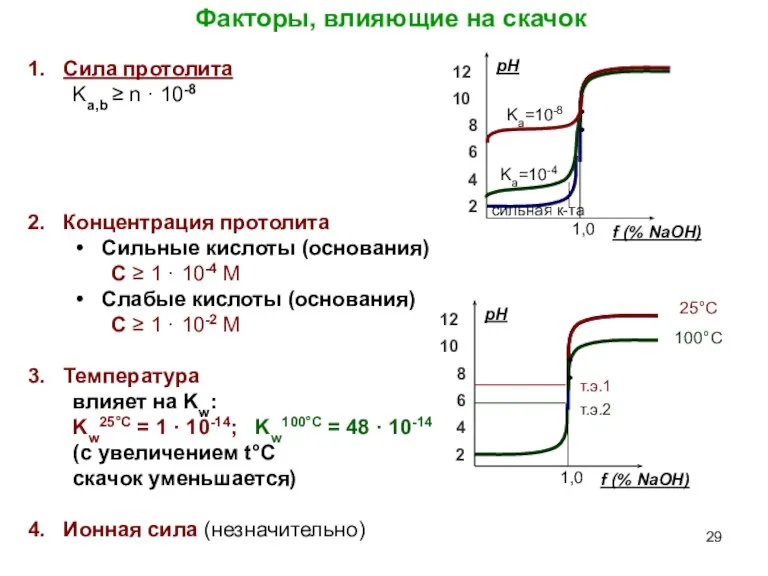
- 29. Факторы, влияющие на скачок Сила протолита Ka,b ≥ n · 10-8 Концентрация протолита Сильные кислоты (основания)
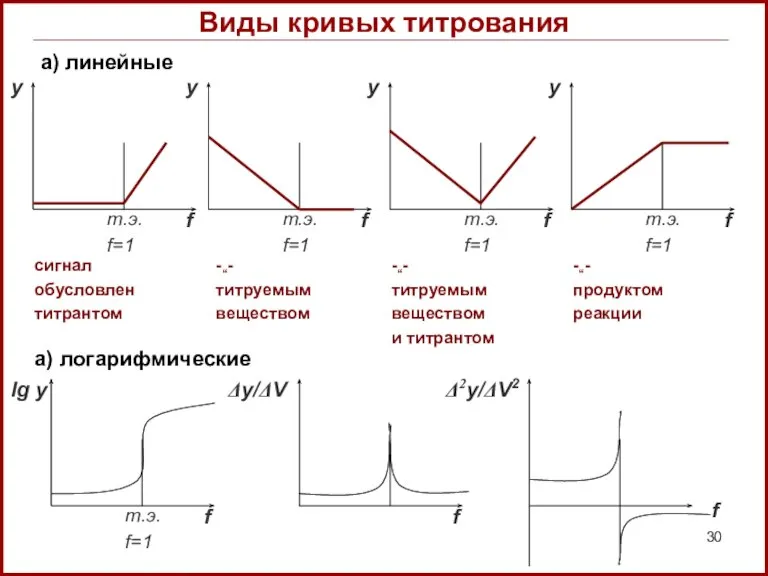
- 30. Виды кривых титрования а) линейные сигнал обусловлен титрантом -“- титруемым веществом -“- титруемым веществом и титрантом
- 32. Скачать презентацию







![Вычисление рН среды [H3O+] pH = - lg aH3O+ ≈ - lg](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1148804/slide-13.jpg)

![Слабые протолиты 1. CH3COOH ↔ CH3COO- + H+ так как [CH3COOH] ≈](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1148804/slide-16.jpg)








 Раздел 1
Раздел 1 Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Щелочноземельные металлы
Щелочноземельные металлы Слідство ведуть знавці
Слідство ведуть знавці Диаграмма состояния BaO-Al2O3-SiO2
Диаграмма состояния BaO-Al2O3-SiO2 Lipidy
Lipidy Химия. Подготовка к контрольной работе
Химия. Подготовка к контрольной работе Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Алкины и их свойства
Алкины и их свойства Физика полимеров Ч1
Физика полимеров Ч1 Периодический закон Д.И.Менделеева
Периодический закон Д.И.Менделеева Качественная реакция на многоатомные спирты
Качественная реакция на многоатомные спирты Алюминий. Применение
Алюминий. Применение История развития органической химии. 10 класс
История развития органической химии. 10 класс Строение вещества
Строение вещества Фуллерены: аллотропы углерода
Фуллерены: аллотропы углерода Презентация на тему Каучуки
Презентация на тему Каучуки  Коррозия металлов
Коррозия металлов 9 класс Урок №8. Аминокислоты. Белки. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.
9 класс Урок №8. Аминокислоты. Белки. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А. Кристаллы
Кристаллы Сахароза. Физические и химические свойства
Сахароза. Физические и химические свойства Химия и сельское хозяйство
Химия и сельское хозяйство Альдегиды и кетоны
Альдегиды и кетоны Соли Na2SO4
Соли Na2SO4 Химические понятия. Вещество. Химические явления. Выдающиеся ученые-химики
Химические понятия. Вещество. Химические явления. Выдающиеся ученые-химики Физико-химия дисперсных систем
Физико-химия дисперсных систем Khim_8
Khim_8 Органическая химия
Органическая химия