Содержание
- 2. Химический состав бурового раствора определяет и влияет на Обзор Взаимодействие его дисперсионной и дисперсной сред Взаимодействие
- 3. Задачи Основные понятия и терминология Щелочность
- 4. Основные понятия и терминология Baroid a Halliburton Company
- 5. Однородная система или вещество - полностью однородны, имеют одинаковые свойства в каждой пробной точке. Неоднородная система
- 6. Отдельные части неоднородных систем отделяются поверхностью раздела, но каждая среда сама по себе будет являться однородной.
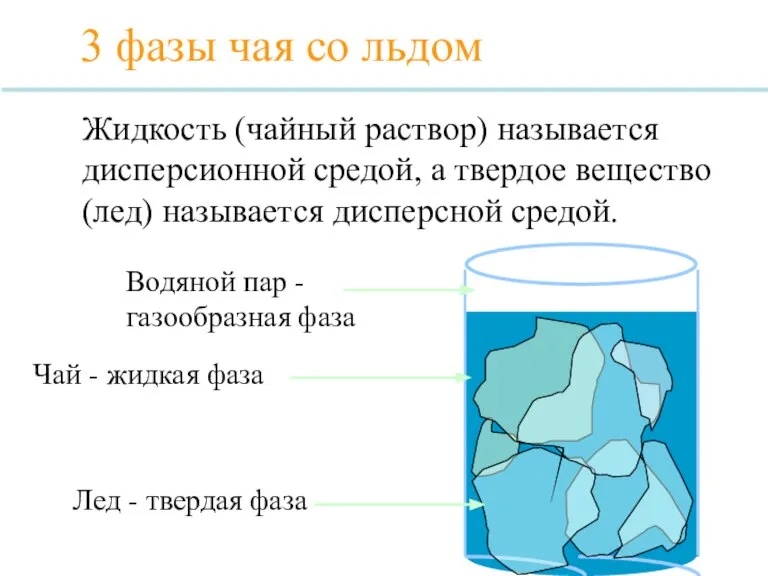
- 7. 3 фазы чая со льдом Лед - твердая фаза Водяной пар - газообразная фаза Чай -
- 8. Газов Жидкостей Твердых веществ, взвешенных в жидкости или газе. 3 фазы бурового раствора Буровой раствор -
- 9. Элементы Элемент - это химическое вещество, единственное в своем роде, которое нельзя упростить или образовать химическим
- 10. Соединение Образовано двумя или более элементарными частицами вещества при неизменном соотношении их масс Новое вещество с
- 11. Формулы представляют собой сочетание элементов, которые образуют молекулу: Молекула - наименьшая частица, которая существует самостоятельно Пример:
- 12. Атомы Атом - наименьшая частица элемента, которая участвует в образовании молекулы. Атомы состоят из более простых
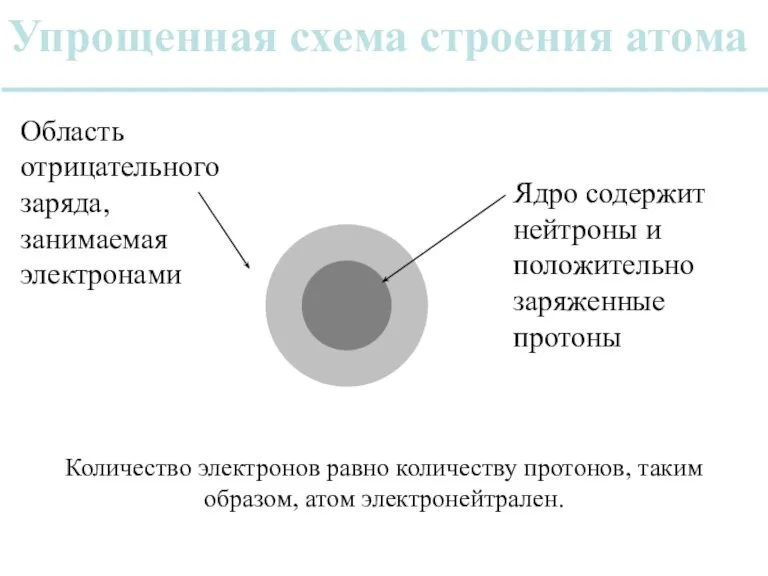
- 13. Упрощенная схема строения атома Ядро содержит нейтроны и положительно заряженные протоны Область отрицательного заряда, занимаемая электронами
- 14. Относительная атомная масса Относительные атомные массы для всех элементов приведены в Периодической таблице с точностью до
- 15. Относительная атомная масса Атомы одного элемента могут иметь различное количество нейтронов в ядре, соответственно и разные
- 16. Атомный номер Определяет атом, т.е. какой это элемент. Все 106 элементов имеют различное количество протонов в
- 17. Атомы и элементы Железо имеет плотность 7.7 г/см3 и является химическим элементом. Атомное число - 26,
- 18. Молекулярная масса Молекула - это частица, состоящая из двух или более атомов, соединенных вместе. Молекулярная масса
- 19. Постоянная Авогадро Число 6.02 x 1023 называется постоянной Авогадро для изотопа C12. Это количество атомов или
- 20. Постоянная Авогадро Один моль воды (молекулярная масса 18) весит 18 грамм, а один моль углерода (атомная
- 21. Химические реакции Химические реакции приводят к изменению энергии и перераспределению электронов, окружающих атомы, участвующие в реакции.
- 22. В результате ионной связи происходит перемещение одного или более электронов от одного атома к другому. Атомы,
- 23. Катион Положительно заряженный ион называется катионом, графически обозначается надстрочным знаком “+”, который пишется после химического знака.
- 24. Анион Атомы, которые приобрели электроны и таким образом стали отрицательно заряженными ионами, называются анионами. Так Cl-
- 25. Пример соединения Соединение натрия с хлором, хлорид натрия, - это кристаллическое вещество, которое структура которого поддерживается
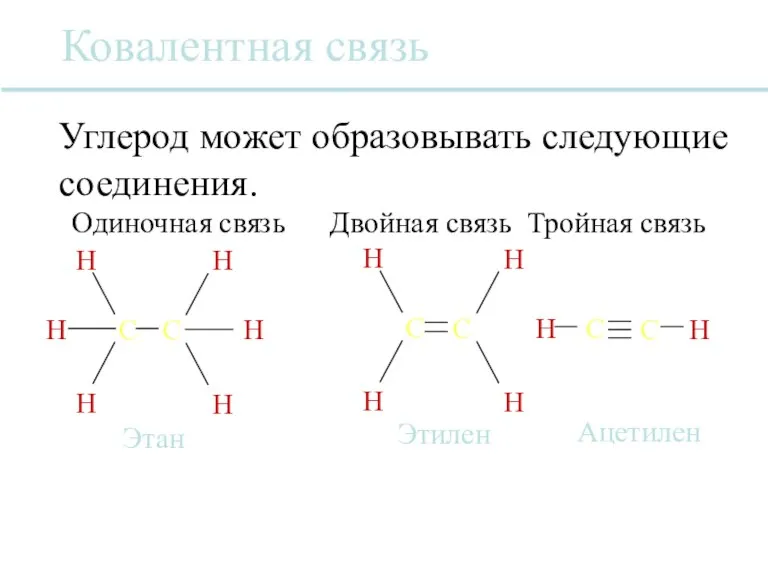
- 26. Ковалентная связь Ковалентная связь возникает, когда электроны распределяются между атомами. Два отдельных атома в одной и
- 27. Ковалентная связь H C H H H C H H H C H H C C
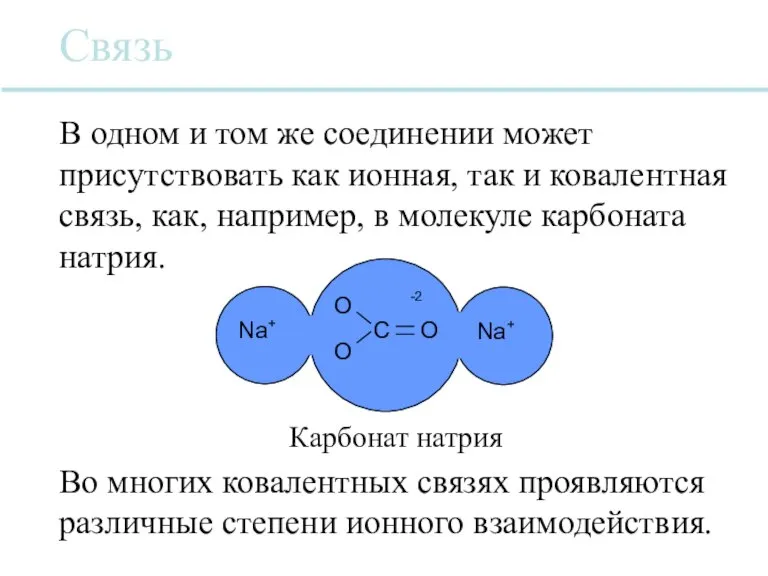
- 28. Na + O O Na + C O -2 Карбонат натрия Связь В одном и том
- 29. Различные виды атомов имеют неодинаковое электронное сродство. Когда образуется ковалентная связь, распределение электронов нарушается в сторону
- 30. Когда электроны распределяются равномерно, частичных зарядов не возникает, и молекула является неполярной. Неполярная ковалентная связь B
- 31. Растворы - это однофазные смеси различных веществ. Два вещества образуют дисперсионную жидкую фазу раствора, известную как
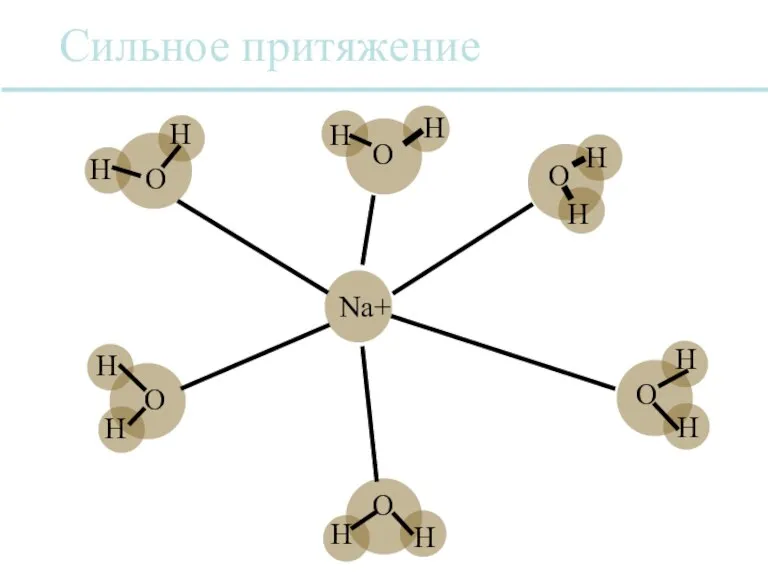
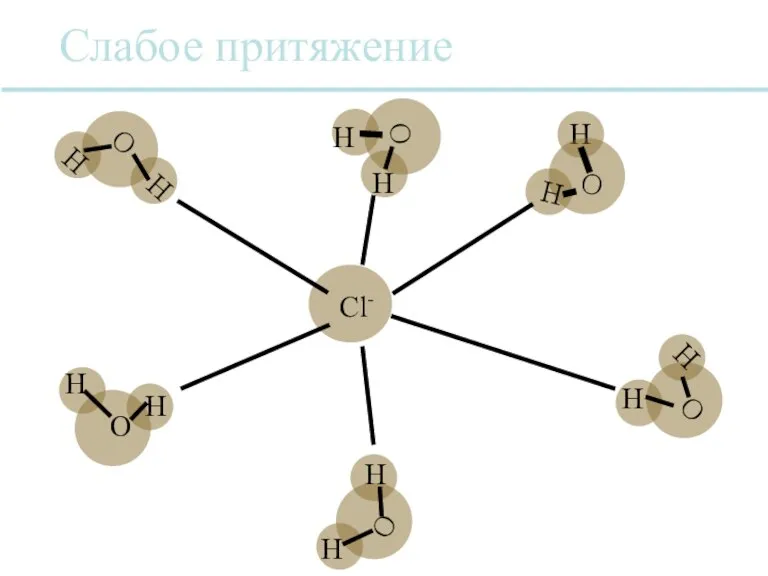
- 32. Вода является универсальным растворителем. Многие ионные соединения растворимы в воде, потому что сила притяжения между противоположно
- 33. Сильное притяжение Na+ O O O O O H H H H H H H H
- 34. Слабое притяжение Cl- O H H H O H O O O H H H H
- 35. Неполярные растворители Дизельное топливо Не сольватирует ионы Ионные соединения не растворимы в дизельном топливе.
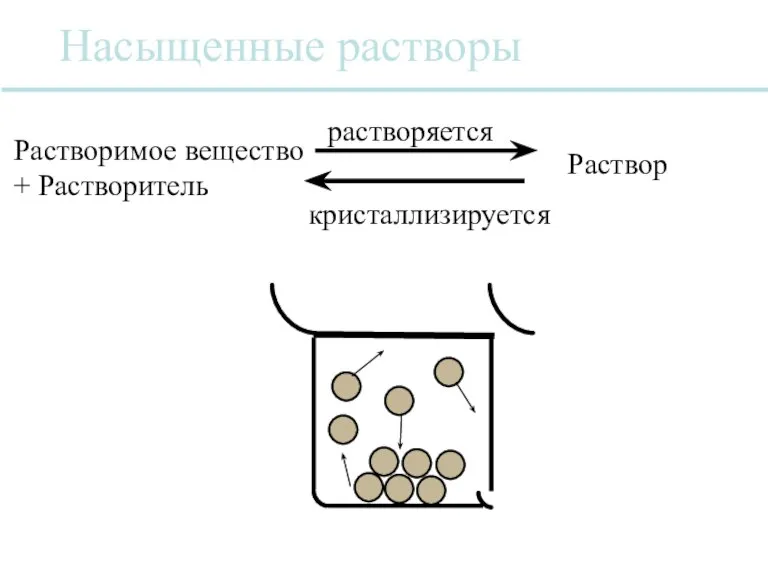
- 36. Насыщенные растворы Растворимое вещество + Растворитель Раствор растворяется кристаллизируется
- 37. Растворимость Растворимость NaCl в воде при температуре 0°F - 35.7 г на 100см3 Насыщенный раствор Ненасыщеннный
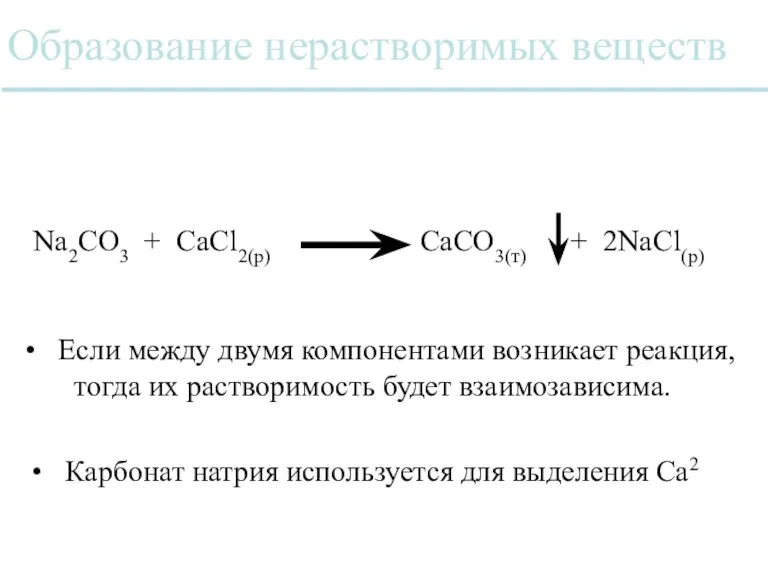
- 38. Образование нерастворимых веществ Na2CO3 + CaCl2(р) CaCO3(т) + 2NaCl(р) Карбонат натрия используется для выделения Ca2 Если
- 39. Кислоты и основания КИСЛОТА вещество, в состав которых входит водород, который может заменяться металлами с образованием
- 40. Щелочность Baroid a Halliburton Company
- 41. Щелочность Определяется растворимыми в воде ионами, которые нейтрализуют кислоту ионы, которые отдают протон (H+) H2SO4 2H+
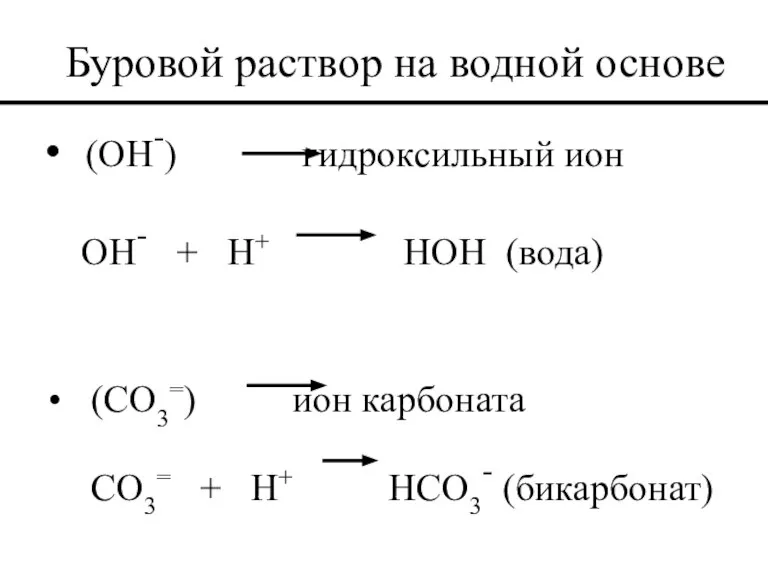
- 42. Буровой раствор на водной основе (OH-) гидроксильный ион OH- + H+ HOH (вода) (CO3=) ион карбоната
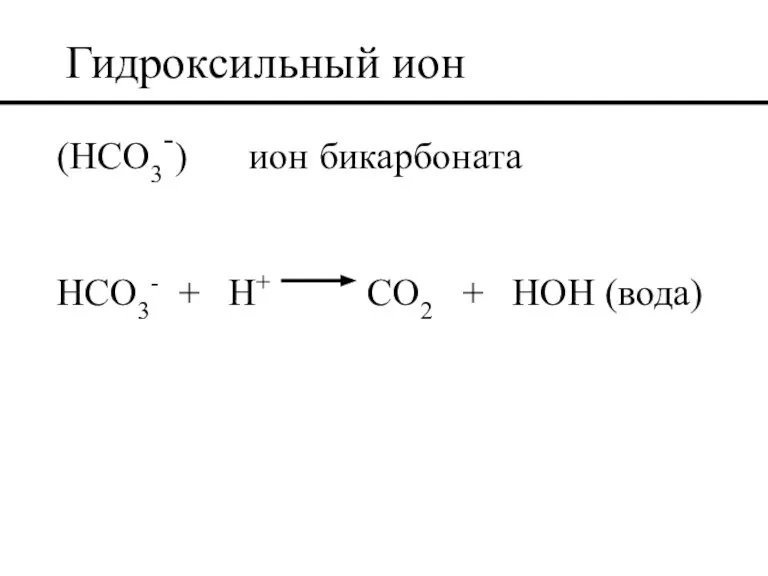
- 43. Гидроксильный ион (HCO3-) ион бикарбоната HCO3- + H+ CO2 + HOH (вода)
- 44. pH pH = - log (H+) (OH-) (H+) = 10 -14 (OH-) (H+) = Kв =
- 45. pH (H+) = 1 X 10 -4 моль/литр pH = 4 (OH-) = 1 X 10
- 46. Источники щелочности OH- (Mg(OH)2) гидроксид магния (Ca(OH)2) гидроксид кальция (известь) (NaOH) гидроксид натрия (едкий натр) (KOH)
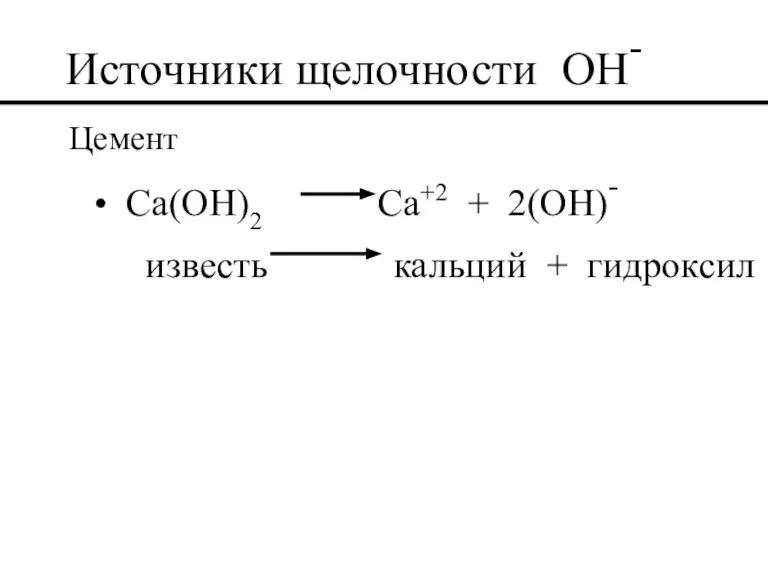
- 47. Источники щелочности OH- Цемент Ca(OH)2 Ca+2 + 2(OH)- известь кальций + гидроксил
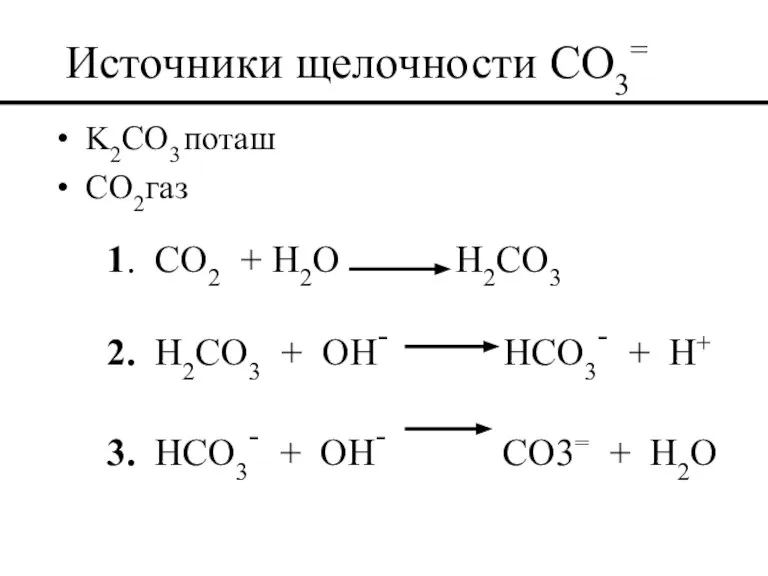
- 48. Источники щелочности CO3= K2CO3 поташ CO2 газ 1. CO2 + H2O H2CO3 2. H2CO3 + OH-
- 49. Источники CO2 Понизители водоотдачи бурового раствора, такие как KWIK SEAL и PHENO SEAL желатинизированный крахмал или
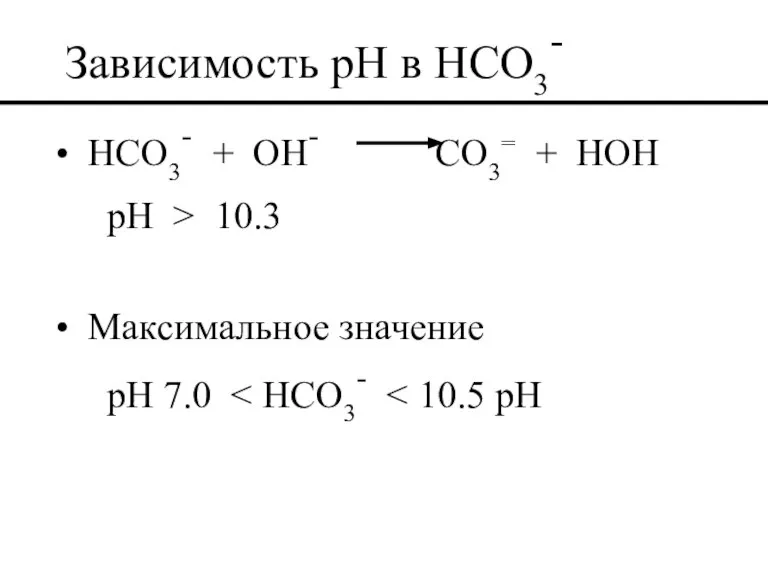
- 50. Зависимость pH в HCO3- HCO3- + OH- CO3= + HOH pH > 10.3 Максимальное значение pH
- 51. 6.3 pH > 10.3 CO3= ион карбоната 4.3 Уровень pH щелочного иона 8.5 11.5
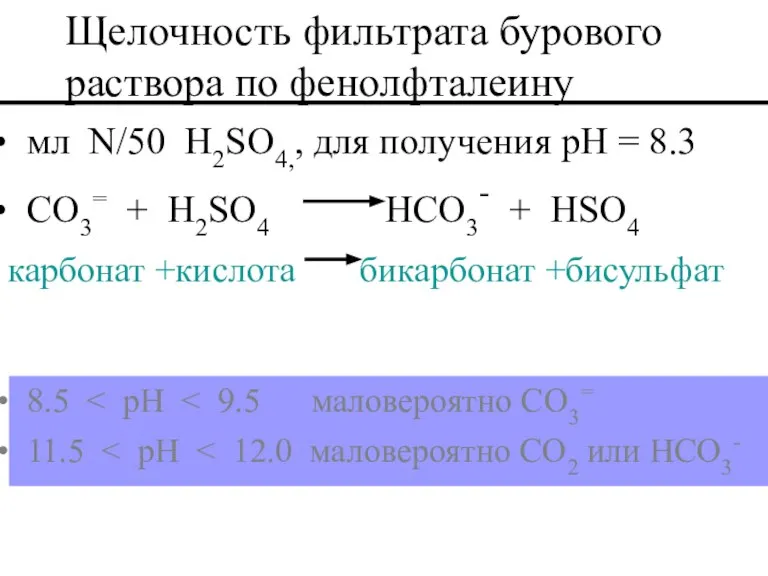
- 52. мл N/50 H2SO4,, для получения pH = 8.3 CO3= + H2SO4 HCO3- + HSO4 карбонат +кислота
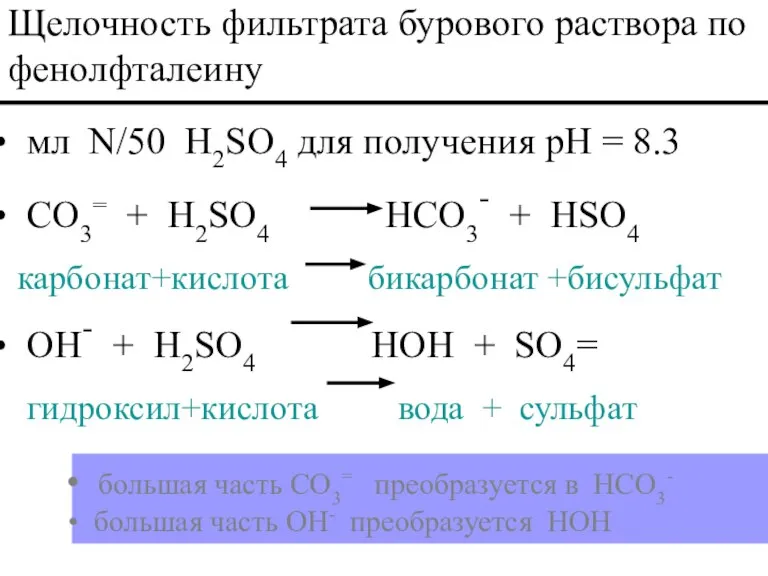
- 53. мл N/50 H2SO4 для получения pH = 8.3 CO3= + H2SO4 HCO3- + HSO4 карбонат+кислота бикарбонат
- 54. мл N/50 H2SO4,, чтобы получить уровень pH = 4.3 HCO3- + H2SO4 CO2 + H2O +
- 55. Высокая щелочность фильтрата бурового раствора по фенолфталеину и по метилоранжу CO3= Высокая щелочность фильтрата бурового раствора
- 57. Скачать презентацию

































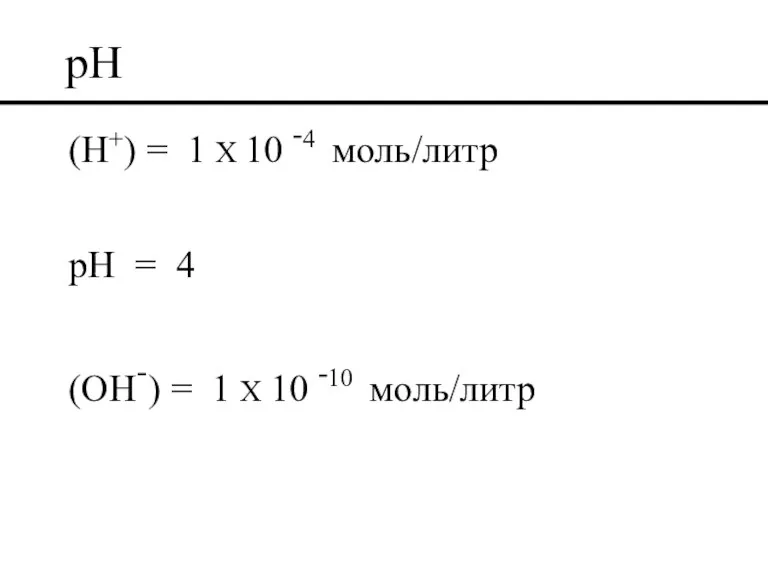





 Характеристика кислорода и серы
Характеристика кислорода и серы Вещества с атомной кристаллической решеткой
Вещества с атомной кристаллической решеткой Химическая связь
Химическая связь Александрит
Александрит Кремнийорганические каучуки
Кремнийорганические каучуки Сказка о братьях карбонатах
Сказка о братьях карбонатах Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C
Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C ОВР химияПрезентация
ОВР химияПрезентация Камень, скользящий на льду
Камень, скользящий на льду Путешествие в страну Металлию. Тест по химии
Путешествие в страну Металлию. Тест по химии Пластификация пластмасс
Пластификация пластмасс Её величество – вода Интегрированный урок химии в 8 классе
Её величество – вода Интегрированный урок химии в 8 классе Презентация на тему Классификация химических реакций 11 класс
Презентация на тему Классификация химических реакций 11 класс  Полезные ископаемые
Полезные ископаемые Пищевая сода
Пищевая сода Строение и физические свойства металлов
Строение и физические свойства металлов Задания по химии
Задания по химии Céramiques lesquelles choisi ?
Céramiques lesquelles choisi ? Кремнийорганические мономеры: Органохлорсиланы
Кремнийорганические мономеры: Органохлорсиланы Многообразие органических веществ
Многообразие органических веществ Способы получения металлов
Способы получения металлов Получение карбоновых кислот
Получение карбоновых кислот Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4)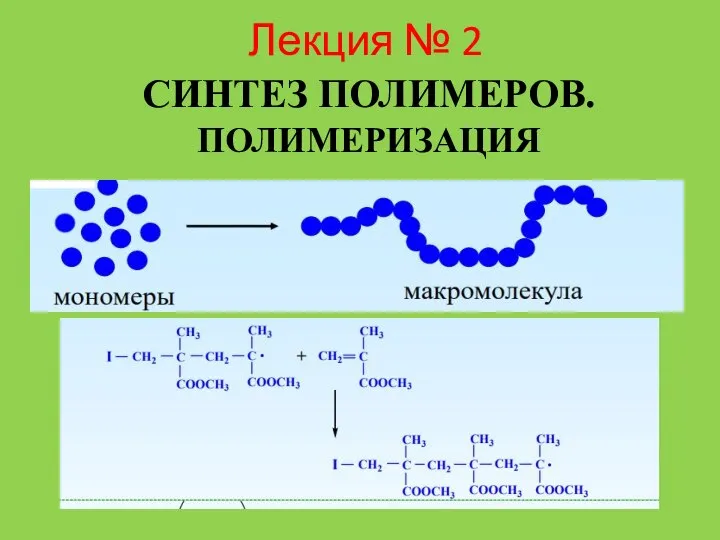 Лекция № 2. Синтез полимеров. Полимеризация
Лекция № 2. Синтез полимеров. Полимеризация Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз
Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз Алканы 10-класс
Алканы 10-класс Особо чистые вещества. Занятие 12
Особо чистые вещества. Занятие 12